Reazione esotermica
- 2432
- 740
- Zelida Gatti
Spieghiamo quali sono le reazioni esotermiche, le loro caratteristiche, le differenze con le reazioni endotermiche e diamo diversi esempi
Quali sono le reazioni esotermiche?
IL reazioni esotermiche Sono reazioni chimiche che rilasciano energia sotto forma di calore. La parola esotermica è formata da "Exo" il che significa "fuori", e "Thermos" il che significa calore, quindi "reazione esotermica" significa letteralmente, reazione in cui si spegne il calore.
Queste reazioni sono molto comuni e possiamo trovarle ovunque, dalle nostre case alle cellule che fanno parte del nostro corpo.
A casa possiamo trovarli in cucina quando il gas brucia nel corno per cucinare il nostro cibo. Li troviamo anche all'interno dei motori dell'auto quando bruciano carburante.
 Un esempio di reazione esotermica
Un esempio di reazione esotermica D'altra parte, le reazioni esotermiche sono essenziali per la vita, poiché forniscono alle cellule l'energia di cui hanno bisogno per vivere, crescere e riprodurre.
Caratteristiche delle reazioni esotermiche
Rilasciano energia sotto forma di calore
Questa è la caratteristica principale che li rende reazioni esotermiche.
L'energia rilasciata proviene dagli stessi reagenti
Ogni reazione chimica richiede una certa energia di attivazione. Nel caso delle reazioni esotermiche, questa energia proviene dagli stessi reagenti se trasformata in prodotti.
I prodotti delle reazioni esotermiche sono sempre più stabili dei reagenti.
I reagenti diventando prodotti, perdono parte della loro energia sotto forma di calore. Per questo motivo, i prodotti rimangono sempre con meno energia dei reagenti, il che li rende più stabili.
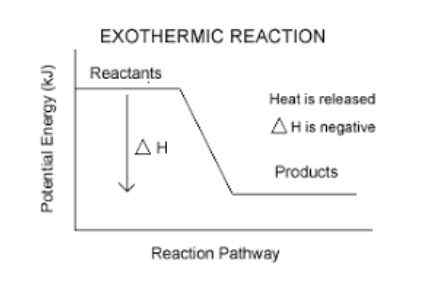
Hanno una variazione di entalpia negativa.
Questo è un modo semplice per sapere se una reazione è esotermica o no. Qualsiasi reazione che abbia un AH (leggi Delta H) negativo, sarà esotermica.
- Per esempio, La reazione a combustione del butano (il gas che bruciamo in cucina) ha una variazione di entalpia di -11.823 kcal/mol. Pertanto, è una reazione esotermica.
Hanno solo bisogno di un grilletto che si verifichi nella maggior parte dei casi.
Molte reazioni esotermiche hanno solo bisogno di qualcosa che dia loro abbastanza energia per iniziare. Dopo questo, lo stesso calore che rilasciano è sufficiente per mantenere la reazione camminata.
- Per esempio, Bruciando il gas, è necessaria solo una scintilla, quindi la fiamma continua ad accendere fino a quando il gas è terminato.
Differenze tra reazioni esotermiche e reazioni endotermiche
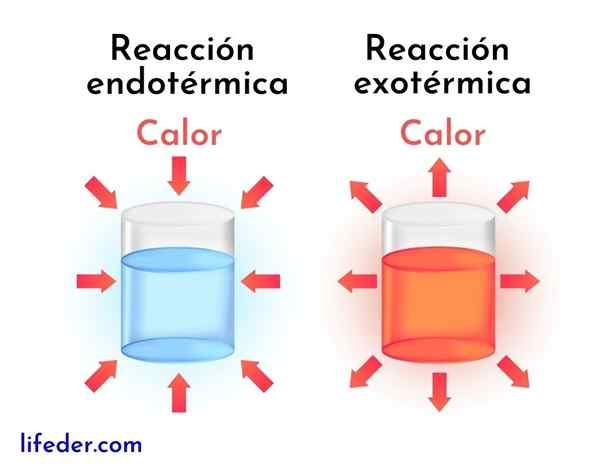
Le reazioni esotermiche sono l'opposto delle reazioni endotermiche. In quest'ultimo caso, i reagenti assorbono l'energia sotto forma di calore anziché rilasciarla, come nelle reazioni esotermiche.
Successivamente, vengono presentate le principali differenze tra reazioni esotermiche ed endotermiche:
Reazioni esotermiche | Reazioni endotermiche |
Rilasciano energia sotto forma di calore. | Assorbono l'energia sotto forma di calore. |
Hanno una variazione di entalpia negativa, cioè DH<0. | Hanno una variazione di entalpia positiva, cioè Dh> 0. |
Tendono ad aumentare la temperatura circostante. | Tendono a ridurre la temperatura o raffreddare. |
L'energia che mantiene la reazione che cammina proviene dagli stessi reagenti. | L'energia che mantiene la reazione che cammina viene da ciò che. |
Prodotti più stabili sono sempre ottenuti con meno energia. | I prodotti meno stabili sono sempre ottenuti con un livello più elevato di energia. |
Esempi di reazioni esotermiche
La combustione di gas da cucina
Nella maggior parte delle case del mondo, il gas usato per cucinare il cibo è butano, che ha la formula molecolare C4H10. Questo idrocarburo viene bruciato con l'ossigeno dell'aria mediante la prossima reazione di combustione che rilascia grandi quantità di calore:
Può servirti: microscopio semplice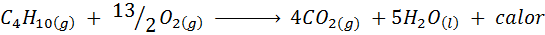
L'esplosione della dinamite
La dinamite contiene un esplosivo chiamato nitroglicerina (c3H5N3O9). Questo composto decompone in modo molto violentemente rilasciando grandi quantità di calore, il che provoca una grande esplosione. La reazione chimica è:
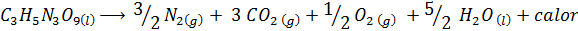
Questa reazione ha un ΔH = -368 kcal⁄Mol, Quindi è una reazione esotermica.
Combustazione spontanea di fosforo bianco
L'elemento fosforo (P) può essere trovato come fosforo rosso o fosforo bianco. Fosforo bianco. La reazione è:
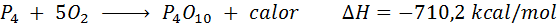
Respirazione cellulare
La respirazione cellulare è una reazione chimica esotermica che consiste nell'ossidazione del cibo che mangiamo. Il calore rilasciato da questa reazione viene utilizzato dalle cellule per eseguire infinite reazioni chimiche endotermiche che richiedono energia.
Fuochi d'artificio
I fuochi d'artificio contengono polvere da sparo nera come componente esplosivo principale. La polvere da sparo è una miscela che contiene nitrato di potassio, grafite e carbonio di zolfo che reagisce tra loro attraverso una reazione esotermica. Il calore che questa reazione rilascia, genera l'ampia gamma di colori che vediamo in cielo quando i fuochi d'artificio esplodono.
Il cuscinetto termico chimico
I cuscinetti termici sono usati come impacchi caldi per alleviare le lesioni sportive. Questi sono costituiti da un sacchetto sigillato contenente acqua e un chimico all'interno di un piccolo tubo. Quando il tubo è rotto, il chimico viene miscelato con l'acqua che produce una reazione chimica esotermica che riscalda il pad.
Reazione metallica del sodio con acqua
Il sodio (NA) è un metallo alcalino molto reattivo che quando si entra in contatto con l'acqua reagisce in modo violentemente rilasciando molto calore e idrogeno gassoso. La reazione è:
Può servirti: metodi di separazione di miscele eterogenee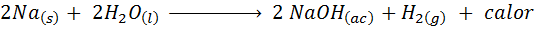
Questa reazione rilascia 1900 calorie per ogni grammo di NA che reagisce con l'acqua. Ciò significa che 1 grammo di sodio sarebbe sufficiente per riscaldare 3 tazze di caffè medio.
Dissoluzione del detergente
Questa è una reazione che chiunque può sperimentare nella propria casa. Quando prendi una manciata di detersivo per spolverare per lavare i vestiti e bagnarlo con un po 'd'acqua, la mano si sentirà immediatamente calda. Questo perché il processo di dissoluzione del detergente in acqua è esotermico.
La reazione TriMita
La termita è una miscela di alluminio sotto forma di polvere molto fine e un ossido di un altro metallo come il ferro. Dopo una scintilla, la reazione che si verifica è:
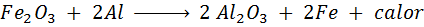
Questa reazione rilascia così tanto calore, che è in grado di sciogliere il ferro e viene utilizzato molto per saldare i treni.
Condensazione dell'acqua
Per tutte le sostanze, le variazioni della fase gassosa (condensa), il liquido a solido (solidificazione) e il gas solido (deposizione), rilasciare sempre calore e quindi sono processi esotermici. Nel caso dell'acqua, la condensa di soli 18 grammi di acqua rilascia circa 10.000 calorie, che è sufficiente per riscaldare 15 piccole tazze di caffè.
Riferimenti
- Chang, R. e Goldsby, K. (2014). Chimica. 11 ° ed. New York: McGraw-Hill Education.
- Reazione esotermica (2020, 19 dicembre). In Wikipedia. Preso da.Wikipedia.org
- Holmes, w. S. (1963). Calore della combustione del fosforo e delle entalpie di formazione di P4O10 e H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. da un., F. Yo. (2014). Petardi, razzi e molta chimica. Istruzione chimica. 44-51. Doi: 10.2436/20.2003.02.134
- Reazione termite. Università del Minnesota (Dipartimento di Chimica). Tratto da Chem.Umn.Edu

