Reazione endergonica

- 1791
- 267
- Lidia Valentini
 Una reazione finale è quella non spontanea e che richiede molta energia
Una reazione finale è quella non spontanea e che richiede molta energia Cos'è una reazione finale?
UN Reazione endergonica È uno che non è spontaneo e richiede anche un ad alta fornitura di energia. In chimica, questa energia è di solito il calorico. I più noti tra tutte le reazioni endotermiche sono le reazioni endotermiche, cioè quelle che assorbono il calore.
Il motivo per cui non tutte le reazioni sono spontanee è perché consumano energia e i sistemi formati dalle specie coinvolti riducono la loro entropia. In altre parole, per scopi chimici, diventano molecolarmente più ordinati.
Costruire un muro di mattoni è un esempio di reazione finale. I mattoni da soli non sono abbastanza compatti da formare un corpo solido. Questo perché non esiste un guadagno di energia che promuova la sua unione (riflessa anche nelle sue possibili interazioni intermolecolari).
Per costruire il muro hai bisogno di cemento e lavoro. Questa è energia e la reazione non spontanea (la parete non sarà costruita automaticamente) diventa possibile se viene percepito un beneficio energetico (economico, nel caso del muro).
Se non ci sono benefici, il muro crollerà a qualsiasi disturbo e i loro mattoni non potranno mai rimanere uniti. Lo stesso vale per molti composti chimici, i cui blocchi di costruzione non possono unirsi spontaneamente.
Caratteristiche di una reazione finale
- Non è spontaneo.
- Assorbire calore (o altro tipo di energia).
Il motivo è che i loro prodotti hanno più energia dei reagenti coinvolti nella reazione. Quanto sopra può essere rappresentato con la seguente equazione:
ΔG = gProdotti-GReagenti
Dove ΔG è il cambiamento dell'energia libera di Gibbs. Come gProdotto è maggiore (perché è più energico) di GReagenti, La sottrazione deve essere maggiore di zero (ΔG> 0). La seguente immagine riassume i nuovi spiegati:
Può servirti: solfato di sodio (Na2SO4): struttura, proprietà, usi, ottenimento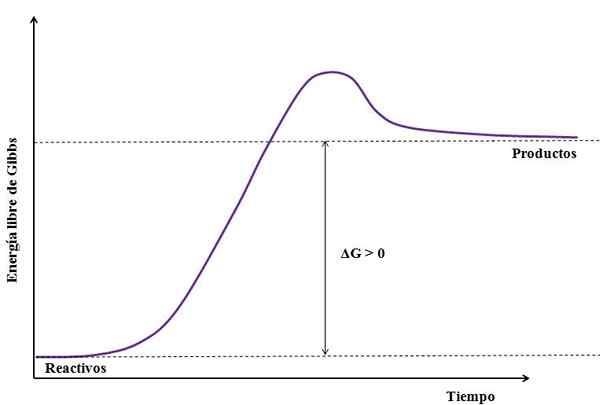 Figura di una reazione endergonica. Fonte: Gabriel Bolívar
Figura di una reazione endergonica. Fonte: Gabriel Bolívar Nota la differenza tra gli stati energetici tra prodotti e reagenti (linea viola). Pertanto, i reagenti non si trasformano in prodotti (a+b => c) se non c'è prima assorbimento del calore.
Aumenta l'energia energetica libera
Ogni reazione endergonica ha un aumento dell'energia libera del sistema del sistema. Se per una certa reazione è soddisfatto che ΔG> 0, allora non sarà spontaneo e richiederà un approvvigionamento di energia per essere eseguita.
Come sapere matematicamente se una reazione è endgonica? Applicare la seguente equazione:
ΔG = ΔH-TΔS
Dove ΔH è l'entalpia della reazione, cioè l'energia totale rilasciata o assorbita, ΔS è il cambiamento di entropia e la temperatura. Il fattore TΔS è la perdita di energia non sfruttata nell'espansione o nell'ordinamento delle molecole in una fase (solido, liquido o soda).
Pertanto, ΔG è l'energia che il sistema può utilizzare per eseguire un lavoro. Poiché ΔG ha un segno positivo per una reazione finale, l'energia o il lavoro (reagenti) devono essere applicati per ottenere i prodotti.
Quindi, conoscendo i valori ΔH (positivi, per una reazione endotermica e negativo, per una reazione esotermica) e TΔS, puoi sapere se la reazione è fine -gononica.
Ciò significa che, sebbene una reazione sia endotermica, NO È necessariamente endogonico.
Il cubo di ghiaccio
Ad esempio, un cubetto di ghiaccio si scioglie in acqua liquida che assorbente il calore, che aiuta a separarsi le molecole; Tuttavia, il processo è spontaneo e, quindi, non è una reazione finale.
Nel caso in cui il ghiaccio sia fondato a una temperatura ben al di sotto di -100 ° C, il termine TΔS dell'equazione di energia libera diventa piccolo rispetto a ΔH (perché T diminuisce) e, di conseguenza, ΔG avrà un valore positivo.
Può servirti: acido carbossilicoIn altre parole: sciogliere il ghiaccio inferiore a -100 ° C è un processo endegonico e non è spontaneo. Un caso simile è quello di congelare l'acqua di circa 50 ° C, il che non si verifica spontaneamente.
I collegamenti dei loro prodotti sono più deboli
Un'altra caratteristica importante, anche correlata a ΔG, è l'energia dei nuovi collegamenti. I collegamenti dei prodotti formati sono più deboli di quelli dei reagenti.
Tuttavia, la diminuzione della forza dei collegamenti viene compensata con un guadagno di massa, che si riflette nelle proprietà fisiche.
Qui il confronto con il muro di mattoni inizia a perdere significato. Secondo quanto sopra, le barre all'interno dei mattoni devono essere più forti di quelle tra loro e il cemento. Tuttavia, il muro nel suo insieme è più rigido e resistente ad avere una massa maggiore.
È abbinato a reazioni esergoniche
Se le reazioni di fine di discesa non sono spontanee, come si svolgono in natura? La risposta è dovuta all'accoppiamento con altre reazioni che sono abbastanza spontanee (esergoniche) e che in qualche modo promuovono il loro sviluppo.
Ad esempio, la seguente equazione chimica rappresenta questo punto:
A + b => c (reazione endergonica)
C + D => E (reazione esergonica)
La prima reazione non è spontanea, quindi naturalmente non potrebbe accadere. Tuttavia, la produzione di C consente che si verifichi la seconda reazione, causando e.
Aggiunta di energie libere di Gibbs per le due reazioni, ΔG1 e ΔG2, Con un risultato inferiore a zero (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Può servirti: idroriSe C non ha reagito con D, non potrei mai formarlo, per non avere una compensazione energetica (come caso di denaro con il muro di mattoni). Si dice quindi che C e D "Jalan" ad A e B per reagire, anche essendo una reazione endegonica.
Esempi di reazioni endergoniche
Fotosintesi
Le piante usano energia solare per creare carboidrati e ossigeno da anidride carbonica e acqua. Il co₂ e o2, Piccole molecole con legami forti, formano zuccheri, di strutture invariate, che sono più pesanti, solide e si sciolgono a una temperatura di circa 186º C.
Si noti che i collegamenti C-C, C-H e C-O sono più deboli di quelli di O = C = O e O = O. E da un'unità di zucchero, la pianta può sintetizzare i polisaccaridi, come la cellulosa.
Sintesi di biomolecole e macromolecole
Le reazioni endermaniche fanno parte dei processi anabolici. Come i carboidrati, altre biomolecole, come proteine e lipidi, richiedono meccanismi complessi che senza di loro e accoppiamento con la reazione di idrolisi dell'ATP, non ci potrebbe essere.
La formazione di diamanti e composti pesanti di greggio
I diamanti richiedono enormi pressioni e temperature, in modo che i loro componenti possano compattare in un solido cristallino.
Tuttavia, alcune cristallizzazioni sono spontanee, sebbene passino a velocità molto lente (la spontaneità non è correlata alla cinetica della reazione).
Infine, il solo petrolio greggio rappresenta un prodotto di reazioni endergoniche, in particolare idrocarburi pesanti o macromolecole chiamate asfaltense.
Le loro strutture sono molto complesse e la loro sintesi ha bisogno di molto tempo (milioni di anni), calore e azione batterica.
Altri esempi
- Respirazione cellulare delle piante.
- Il trasporto di ossigeno nel flusso sanguigno.
- La diffusione degli ioni attraverso le membrane cellulari.
- Contrazione muscolare.
- Sintesi proteica cellulare.
Riferimenti
- Reazioni endermaniche ed eseroniche. Recuperato da Quimitube.com
- Energia gratis. Recuperato da ES.Khan Academy.org
- Definizione di reazione endergonica. Estratto dalla biologia.netto

