Tipi di reazione di sintesi, fattori, esempi
- 985
- 26
- Rosolino Santoro
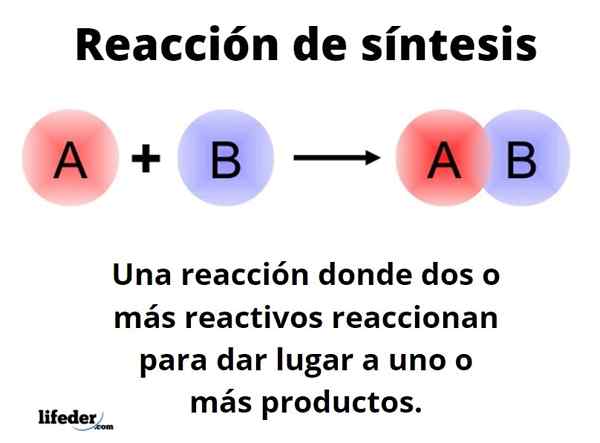
IL Reazione di sintesi È uno in cui due o più reagenti reagiscono per essere in grado di originare, quantitativamente, uno o più prodotti, a livello di laboratorio o industriale. Questa è una delle reazioni più fondamentali della chimica e i suoi tipi e progetti confinano quasi l'infinito.
Il modo generico può essere rappresentato con la forma: A+B → C. In una semplice reazione di sintesi, un reagente a reagire con un altro reagente B, per produrre un prodotto C. Si dice che consiste in un solo passo. Tuttavia, può succedere che reagire prima con E, seguito da F e infine con G (altri reagenti), per trasformarsi in prodotto C; cioè, la stessa reazione si svolge in più passaggi.

Indipendentemente da un singolo passo o molti, tutte le reazioni di sintesi si basano sull'efficacia (termodinamica e cinetica) con cui i reagenti reagiscono a trasformarsi in prodotti, nonché prestazioni sperimentali. Si desidera che una reazione di sintesi passi con successo e produca il maggior numero possibile di prodotti.
[TOC]
Tipi di reazioni di sintesi
Semplice o multiplo
Le reazioni di sintesi non sono del tutto facili da classificare. Può essere un problema relativo ai criteri del chimico. Perché? Supponiamo che la reazione multipla commentata sopra:
A + e → p1
P1 + F → p2
P2 + G → C
Essere p1 E p2 intermediari che non sono di interesse. La reazione della sintesi del prodotto o del composto C, a partire da A come reagente principale (limitazione o reagente limitante), è multipla o complessa, perché si verifica in diversi passaggi, a cui partecipano altri reagenti: E, F e G.
Ciascuna delle tre reazioni precedenti può consistere e un tipo di reazione chimica in se stessi. Cioè, una reazione di sintesi può essere di qualsiasi altro tipo di reazioni chimiche (doppio spostamento, redox, combustione, neutralizzazione, nitrazione, sostituzione, ecc.), fintanto che ha origine un prodotto e ha prestazioni sperimentali associate.
COSÌ:
A + e → p1
Può essere visto come una semplice reazione di sintesi per il prodotto p1, indipendentemente dal tipo di reazione che è. E anche:
P1 + F → p2
È un'altra semplice reazione di sintesi per il prodotto p2.
Inorganico o organico
Le reazioni di sintesi possono essere di qualsiasi tipo per quanto riguarda la natura della reazione e il suo meccanismo molecolare. Tuttavia, questi possono essere divisi in base alla natura chimica di reagenti e prodotti.
Può servirti: acetato di sodio: struttura, proprietà, sintesi, usiAd esempio, se i reagenti sono sostanze inorganiche, allora parliamo di sintesi inorganica; Mentre se fossero sostanze organiche, parleremmo già di sintesi organica.
Il campo della sintesi organica è colossale, in quanto copre le produzioni di farmaci, coloranti, materie plastiche, insetticidi, adesivi, profumi, conservanti, tra migliaia di altri prodotti.
Fattori coinvolti nelle reazioni di sintesi
I fattori coinvolti nelle reazioni di sintesi sono tutti quei parametri o variabili, fisici e chimici, che influenzano direttamente le prestazioni di reazione e la qualità dei prodotti hanno avuto origine. Alcuni di loro sono i seguenti:
Temperatura
La temperatura è essenziale in qualsiasi reazione di sintesi. A seconda della termodinamica, può essere conveniente per rimanere basso o alto. Allo stesso modo, ci sono intervalli di temperature in cui sono probabili reazioni laterali indesiderabili, quindi è essenziale controllarlo e verificarlo in ogni momento.
Tempo
Il tempo è anche essenziale nelle reazioni di sintesi, perché deve assicurarsi che sia sufficiente garantire l'istituzione di equilibrio. Dopo un certo periodo di tempo, più prodotto cesserà di essere ottenuto, ed è quando si decide di fermare completamente la sintesi.
Concentrazioni e qualità dei reagenti
Più sono concentrati i reagenti, più velocemente saranno le reazioni. Tuttavia, è anche essenziale essere chiari sulla proporzione delle sue concentrazioni, nonché le sue magnitudini, poiché il cambiamento minimo influenzerà le prestazioni finali.
D'altra parte, i reagenti devono essere il più puri possibile, altrimenti si assumeranno concentrazioni errate; O peggio, i prodotti saranno contaminati o si verificheranno reazioni indesiderate.
Agitazione
Il modo in cui il mezzo di reazione viene agitato influenzerà i rapidi delle reazioni di sintesi.
Pressione
La pressione, come la concentrazione, svolge un ruolo cruciale, specialmente quando i reagenti sono specie di soda o sostanze. Maggiore è la pressione, maggiore è le collisioni o le interazioni tra i reagenti e, pertanto, ci sarà più probabilità di reagire.
ph
Il pH (acido o base) influisce direttamente sul meccanismo di una reazione, quindi è un fattore chiave nella definizione di quali prodotti verranno ottenuti alla fine della sintesi.
Può servirti: punto di ebollizione: concetto, calcolo ed esempiCatalizzatori
I catalizzatori sono sostanze che accelerano le reazioni chimiche ma senza consumate durante il processo. C'è una sintesi che senza il tuo intervento sarebbe impossibile.
Esempi di reazioni di sintesi
Successivamente, e infine, saranno citate equazioni chimiche per le reazioni di sintesi di diversi composti.
Sale da tavola (cloruro di sodio)
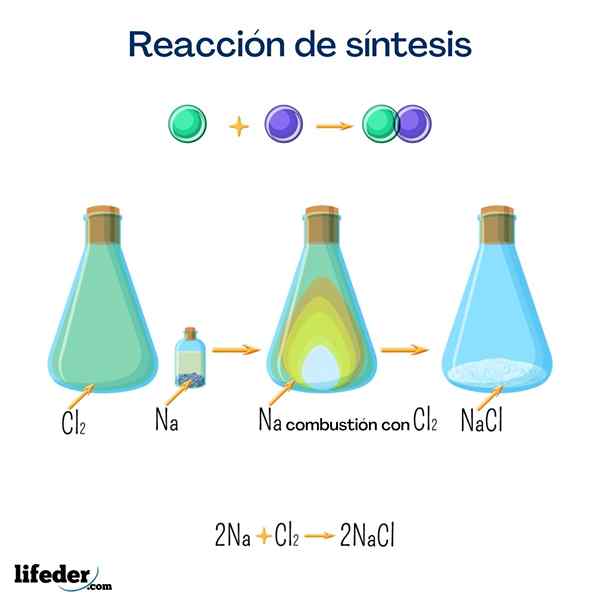
Questo sale è uno dei più conosciuti da tutti per il suo grande uso domestico. È ottenuto dal sodio e dal cloro e sebbene possa essere ottenuto con la seguente reazione, è molto facile trovarlo in modo naturale.
2 Na+Cl 2 → 2 NaClGlucosio
Questa è una delle reazioni più importanti per la vita come la conosciamo. Le piante usano l'anidride carbonica e l'ambiente dell'ambiente con luce solare per produrre glucosio e ossigeno.
La reazione in modo molto generale può essere vista di seguito, ma è importante capire che dietro di esso ci sono diverse reazioni e meccanismi per questo.
6CO2 + 6H2O → C6H12O6 + O2
Saccarosio
Questa reazione di sintesi si verifica negli organismi viventi e viene somministrata quando il glucosio polimerizzante con fruttosio. A causa della loro struttura, queste due molecole interagiscono e il risultato finale è saccarosio e acqua, come si può vedere nella seguente equazione:
C6H12O6 + C6H12O6 → C12H22O11 + H2O
Ammoniaca
3 h2(g) + n2(g) → 2 NH3(G)
I reagenti h2 e n2 Sono gassosi. La pressione deve essere elevata affinché le molecole reagiscano e originino l'ammoniaca, NH3. Questa è una delle reazioni di sintesi più importanti della chimica industriale.
Acqua
2 h2(g) + o2(g) → 2 h2O (g)
Il h2 IO2 reagire esotermicamente per produrre vapore acqueo. La quantità di energia rilasciata è tale che l'idrogeno è uno dei carburanti più promettenti nelle applicazioni aerospaziali.
Alcool
C2H4(g) + H2O (L) → Cho3Cap2Oh (l)
L'etanolo è noto come alcol, essendo solo uno dei tanti alcoli che esistono. La sua reazione di sintesi consiste nell'idratazione dell'etilene, c2H4 o h2C = ch2, dove una molecola d'acqua viene aggiunta al suo doppio legame.
Acido solforico
L'acido solforico ha diversi percorsi sintetici efficienti. Tuttavia, il più semplice è costituito da diversi passaggi:
Può servirti: carbossimetilcellulosaS (s) +o2(g) → Quindi2(G)
2 Quindi2(g)+o2(g) ⇌ 2 SO3(G)
SW3(g)+H2O (l) → h2SW4(G)
H2SW4(g) → H2SW4(L)
Lo zolfo brucia con eccesso di ossigeno per prima trasformarsi in SO2, E poi in così3. Quindi il SO3 è idratato per produrre vapori H2SW4, che finalmente condensano in H2SW4 liquido. Questa sintesi è così importante, che di per sé indica quanto forte.
Metanolo
CO (G) + 2 h2(g) → CH3Oh (l)
The Gases Co e H2 reagire e condensare i catalizzatori di metallo per dare origine al metanolo, l'alcool più semplice di tutti.
Solfato di magnesio
Può verificarsi da una reazione molto semplice che consiste in magnesio e acido solforico. È molto difficile trovarlo in natura senza acqua.
Mg + H2SO4 → H2 + MGSO4
Diossido di carbonio
Succede naturalmente in diversi processi, quando l'anidride carbonica viene prodotto con molecola di anidride carbonica.
È presente in processi naturali come la respirazione, come reagente nella fotosintesi e si verifica facilmente nelle reazioni di combustione.
C +O2 → CO2
Acido cloridrico
L'acido cloridrico è ampiamente usato come acido economico e come agente reattivo per la sintesi di altri composti.
Cl2+H2 → 2HCL
Carbonato di calcio
È ampiamente noto come un agente molto abbondante in natura, principalmente in rocce, minerali e conchiglie nel mare. La sua reazione si basa sull'interazione di ossido di calcio con anidride carbonica.
Cao +CO2 → Caco3
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. (10th Edizione.). Wiley Plus.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Metler Toledo. (S.F.). Reazioni di sintesi. Recuperato da: MT.com
- Helmestine, Anne Marie, PH.D. (27 agosto 2020). Descrizione della reazione di sintesi più esami. Estratto da Thoughtco.com
- Wikipedia. (2020). Sintesi chimica. Recuperato da: in.Wikipedia.org
- Danielle Reid. (2020). Reazione di sintesi: definizione, formula ed esempio. Studio. Recuperato da: studio.com

