Caratteristiche di chimotripsina, struttura, funzioni, meccanismo d'azione
- 5047
- 1562
- Cosetta Messina
IL chimotripsin È la seconda proteina digestiva più abbondante dal pancreas verso l'intestino tenue. È un enzima appartenente alla famiglia delle serine-protee ed è specializzato nell'idrolisi dei legami peptidici tra aminoacidi come tirosina, fenilalanina, triptofano, metodo e leucina presenti in grandi proteine.
Il nome "Chemotripsin" riunisce, in realtà, un gruppo di enzimi che sono prodotti dal pancreas e che partecipano attivamente alla digestione intestinale delle proteine negli animali. La parola deriva dall'azione della renina che questo enzima ha sul contenuto gastrico o sul "chimo".
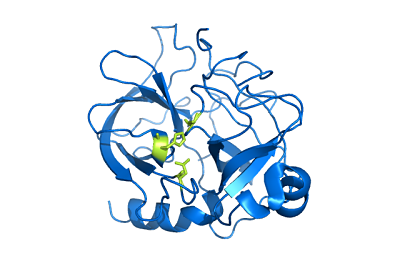
 Struttura Chimotripsin (Fonte: Utente: Mattyjenjen [Attribution] tramite Wikimedia Commons)
Struttura Chimotripsin (Fonte: Utente: Mattyjenjen [Attribution] tramite Wikimedia Commons) Sebbene non si sappia esattamente quanto sia ampia la sua distribuzione nel regno animale, si ritiene che questi enzimi siano presenti almeno in tutti gli agnelli e ci sono segnalazioni della loro presenza in "bordi più primitivi" come gli artropodi e quello di i Celestroads.
In quegli animali che hanno pancreas, un tale organo è il sito principale della produzione di chimotripsina, nonché altre proteasi, inibitori enzimatici e precursori o zimogeni.
Le chimotripins sono gli enzimi più studiati e meglio caratterizzati, non solo in relazione alla loro biosintesi, ma anche con la loro attivazione da zimogen, le sue proprietà enzimatiche, la sua inibizione, le sue caratteristiche cinetiche e catalitiche e la sua struttura generale.
[TOC]
Caratteristiche e struttura
Le chimotripins sono endopeptidasi, cioè sono proteasi che idrolizzano i legami peptidici di aminoacidi in posizioni "interne" di altre proteine; Sebbene sia stato anche dimostrato che possono idrolizzare esteri, Amidas e Arilamidas, sebbene con meno selettività.
Hanno un peso molecolare medio di circa 25 kDa (245 aminoacidi) e sono prodotti da precursori noti come chemiotripsinogeni.
Dal pancreas di animali bovini, sono stati purificati 2 tipi di chemiotripsinogeni, A e B. Nel modello di maiale è stato descritto un terzo chemiotripsinogeno, il chimotripsinogen C è stato descritto. Ognuno di questi tre zimogeni è responsabile della produzione di chimotropsine A, B e C, rispettivamente.
Può servirti: Flora e fauna Quintana RooLa chimotripsina A è formata da tre catene polipeptidiche che sono covalentemente collegate tra loro attraverso ponti o legami disolfuro tra residui di cisteina. Tuttavia, è importante menzionare che molti autori lo considerano un enzima monomerico (composto da una singola subunità).
Queste catene costituiscono una struttura che ha una forma di ellissoide, in cui i gruppi che hanno carichi elettromagnetici si trovano verso la superficie (ad eccezione degli aminoacidi che partecipano a funzioni catalitiche).
Generalmente le chimotropsine sono estremamente attive al pH acido, sebbene quelle che sono state descritte e purificate dagli insetti e altri animali non vertebrati siano stabili a pH tra 8 e 11 e estremamente instabili per abbassare il pH.
Funzioni chemiotripsin
Quando viene stimolato il pancreas esocrino, sia dagli ormoni che dagli impulsi elettrici, questo organo rilascia granuli secretari ricchi di chemiotripsinogen proteina completamente attiva.
Forse la funzione principale di questo enzima è quella di agire in concerto con le altre proteasi escrete verso il sistema gastrointestinale per la digestione o la degradazione delle proteine consumate.
I prodotti di tale proteolisi successivamente fungono da fonte di carbonio ed energia attraverso il catabolismo degli aminoacidi o possono essere "riciclati" direttamente per la formazione di nuove proteine cellulari che eserciteranno funzioni multiple e variate a livello fisiologico.
Meccanismo di azione
Le chimotripins esercitano le loro azioni solo dopo essere state attivate, poiché queste sono prodotte come "precursore" (zimogen) chiamate chemiotropsinogeni.
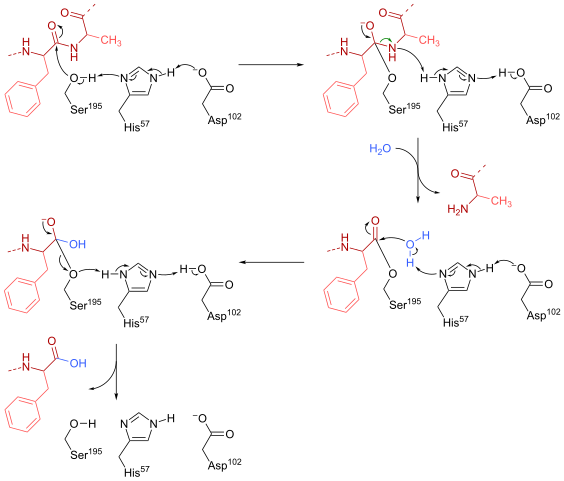 Meccanismo di reazione di Quimotripsin (fonte: HBF878 [CC0] tramite Wikimedia Commons)
Meccanismo di reazione di Quimotripsin (fonte: HBF878 [CC0] tramite Wikimedia Commons) Formazione
Gli zimogeni di chimotripsina sono sintetizzati dalle cellule acinari del pancreas, dopo di che migrano dal reticolo endoplasmatico al complesso del Golgi, dove sono confezionati all'interno di complessi membrani o granuli secretari.
Può servirti: scienze che sono legate alla biologiaQuesti granuli si accumulano alle estremità degli acini e vengono rilasciati in risposta a stimoli ormonali o impulsi nervosi.
Attivazione
A seconda delle condizioni di attivazione, si possono trovare diversi tipi di chimotripinsine, tuttavia, tutti implicano il "taglio" proteolitico di un collegamento peptidico in zimogeno, chimotripsinogen, un processo catalizzato dai trincesi enzimatici.
La reazione di attivazione è inizialmente consiste nel legame di taglio tra gli aminoacidi 15 e 16 dei chimotripsinogen, che forma la quimotripsina π.
L'azione di quest'ultimo enzima promuove la formazione di dopo i peptidi per mezzo della catena C-terminale, che inizia con il residuo 149).
Le porzioni corrispondenti ai rifiuti 14-15 e 147-148 (due dipéptidi) non hanno funzioni catalitiche e si staccano dalla struttura principale.
Attività catalitica
La chimotripsina è responsabile dell'idrolizzante legami peptidici, attaccando prevalentemente la porzione carbossilica di aminoacidi che hanno gruppi laterali aromatici, cioè aminoacidi come tirosina, triptofano e fenilalanina.
Una serina (essendo 195) all'interno del sito attivo (Serie Gly-Asp-Gly-Glu-Ala-Val) di questo tipo di enzimi è forse il residuo più essenziale per il suo funzionamento. Il meccanismo di reazione è il seguente:
- La chimotripsina si trova inizialmente in una forma "senza substrato", in cui la triade catalitica "è costituita dal gruppo carbossilico laterale di un residuo aspartato (102), l'anello di imidazolo di un residuo di istidina (57) A Serine (195).
- Il substrato incontra l'enzima e si unisce a questo per formare un tipico complesso reversibile dell'enzima-substrato (secondo il modello Micaeliano), in cui la "triade" catalitica facilita l'attacco nucleofile attivando il gruppo idrossile della serina della serina.
Può servirti: basi di azoto: cosa sono, classificazione, funzioni- Il punto chiave del meccanismo di reazione consiste nella formazione di un collegamento parziale, che si traduce nella polarizzazione del gruppo idrossile, che è sufficiente per accelerare la reazione.
- Dopo l'attacco nucleofilo, il gruppo carbossilico diventa un intermediario di ossianion tetraedrico, che è stabilizzato da due ponti idrogeno formati da gruppi N e H del residuo di gly 193 ed essendo 195.
- L'ossanione è spontaneamente "riorganizzazione" e si forma un intermediario enzimatico a cui è stato aggiunto un gruppo acilico (enzima acyled).
- La reazione continua con l'ingresso di una molecola d'acqua nel sito attivo, una molecola che promuove un nuovo attacco nucleofilo che si traduce nella formazione di un secondo intermediario tetraedrico che è anche stabilizzato da ponti idrogeno.
- La reazione termina quando questo secondo intermediario viene nuovamente riorganizzato e forma di nuovo il complesso micaeliano dell'enzima-substrato, in cui il sito attivo dell'enzima è occupato dal prodotto contenuto nel gruppo carbossilico.
Riferimenti
- Appel, w. (1986). Chimotripsina: proprietà molecolari e catalitiche. Biochimica clinica, 19 (6), 317-322.
- Bender, m. L., Killheffer, j. V., & Cohen, s. (1973). Chimotripsina. Recensioni critiche CRC in biochimica, 1 (2), 149-199.
- Colpo, d. M. (1971). 6 La struttura della chimotripsina. Negli enzimi (vol. 3, pp. 185-212). Academic Press.
- Colpo, d. M. (1976). Struttura e meccanismo della chimotripsina. Conti della ricerca chimica, 9 (4), 145-152.
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Polgár, l. (2013). Meccanismi catalitici di peptidi serina e treonina. Nel manuale di enzimi proteolitici (PP. 2524-2534). Elsevier Ltd.
- Westheimer, f. H. (1957). Ipotesi per il meccanismo d'azione della chimotripsina. Atti della National Academy of Sciences of the United States of America, 43 (11), 969.
- « Sintesi, trasposizione e usi dell'acido benzilico
- Caratteristiche di apprendimento visivo, strategie, attività, esempi »

