Punto d'equivalenza

- 2489
- 178
- Kayla Serr
 Il punto di equivalenza è la concentrazione di valore aggiunto stechiometricamente pari alla quantità di analita
Il punto di equivalenza è la concentrazione di valore aggiunto stechiometricamente pari alla quantità di analita Qual è il punto di equivalenza?
Lui punto d'equivalenza È uno in cui due sostanze chimiche sono state completamente reagite. Nelle reazioni a base di acido, questo punto indica quando un acido intero o una base è stato neutralizzato.
Questo concetto è quotidiano in gradi o valutazioni volumetriche ed è determinato da semplici calcoli matematici.
A questo proposito, un grado è il processo in cui viene attentamente aggiunto un volume di una soluzione di concentrazione nota, chiamata titolare, a una soluzione di concentrazione sconosciuta, al fine di ottenerne la concentrazione.
L'uso di un indicatore di pH consente di sapere il momento in cui il grado finisce. L'indicatore viene aggiunto alla soluzione che viene intitolata per eseguire la quantificazione della concentrazione che si desidera sapere.
Un indicatore a base di acido è un composto chimico il cui colore dipende dalla concentrazione di idrogeno o dal pH del mezzo.
Il cambiamento di colore dell'indicatore indica il punto finale del grado, sebbene non il punto di equivalenza. Idealmente, entrambi i punti devono coincidere, ma in realtà il cambiamento di colore può verificarsi alcune gocce dopo che la neutralizzazione dell'acido o la base è stata completata.
Qual è il punto di equivalenza?
Una soluzione di un acido di concentrazione sconosciuto collocato in un pallone.
La selezione di un indicatore deve essere effettuata in modo tale da cambiare il colore nel punto che hanno reagito la stessa quantità di equivalenti chimici della soluzione titolante e la soluzione di concentrazione sconosciuta.
Questo è il punto di equivalenza, mentre il punto in cui un indicatore cambia il colore è chiamato punto finale, in cui il titolo finisce.
Può servirti: soluzione ipotonica: componenti, preparazione, esempiPunto finale
La ionizzazione o la dissociazione dell'indicatore è rappresentata come segue:
Hin +h₂o in- + H3O+
E quindi ha un ka costante
Ka = [h3O+] [In-] / [Hin]
La relazione tra l'indicatore non discattato (HIN) e l'indicatore dissociata (in-) Determina il colore dell'indicatore.
L'aggiunta di un acido aumenta la concentrazione di hin e produce il colore 1 dell'indicatore. Nel frattempo, l'aggiunta di una base favorisce un aumento della concentrazione dell'indicatore dissociata (in-) (Colore 2).
È desiderabile che il punto di equivalenza coincida con il punto finale. Per fare ciò, un indicatore viene selezionato con un intervallo di cambio di colore che include il punto di equivalenza. Inoltre, si tratta di ridurre qualsiasi errore che produce una differenza tra il punto di equivalenza e il punto finale.
La standardizzazione o la valutazione di una soluzione è un processo in cui viene determinata la concentrazione esatta di una soluzione. È metodologicamente un grado, ma la strategia seguita è diversa.
Una soluzione dello standard primario viene inserita nel pallone e la soluzione titolare che viene standardizzata viene aggiunta con una burette.
Equivalenza della titolazione di un acido forte con una base forte
100 ml di 0,1 M HCl viene posizionato nel pallone e aggiunto gradualmente, per mezzo di una buretta, una soluzione NaOH 0,1 M, determinando le variazioni di pH della soluzione che causa l'acido cloridrico.
Inizialmente, prima di aggiungere NaOH, il pH della soluzione HCL è 1.
Viene aggiunta la base forte (NaOH) e il pH aumenta gradualmente, ma rimane un pH acido, poiché l'eccesso di acido determina questo pH.
Può servirti: ioduro di potassio (ki): struttura, proprietà, ottenimento, usi, rischiSe NaOH continua, c'è un tempo in cui viene raggiunto il punto di equivalenza, in cui il pH è neutro (pH = 7). L'acido ha reagito con il consumo di base, ma non c'è ancora eccesso di base.
Predomina la concentrazione di cloruro di sodio, che è un sale neutro (né il NA+ né il cl- sono idrolizzati).
Se NaOH continua, il pH continua ad aumentare, diventando più semplice del punto di equivalenza, perché la concentrazione di NaOH prevale.
Idealmente, il cambio di colore dell'indicatore dovrebbe verificarsi a un pH = 7, ma a causa della brusca forma della curva di titoling, si può usare la fenolftaleina che cambia in un colore rosa pallido a un pH intorno a 8.
Curva di laurea a base in autunno
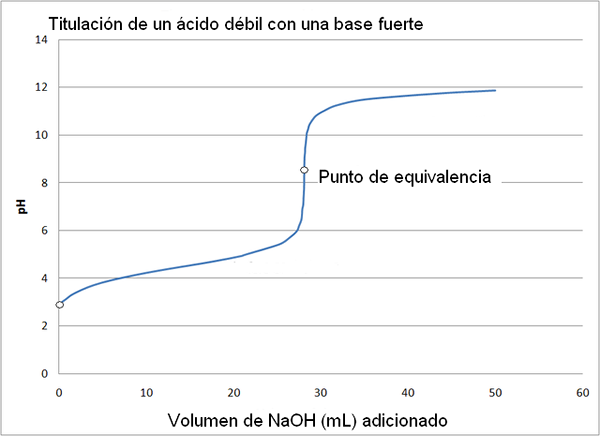 Acido debole e curva di titolazione della base forte. Fonte: Wikimedia Commons
Acido debole e curva di titolazione della base forte. Fonte: Wikimedia Commons La curva di titolazione di un forte acido con una base forte è simile a quella dell'immagine superiore. L'unica differenza tra entrambe le curve è che la prima ha un cambiamento di pH molto più brusco, mentre nella curva di titolazione di un acido debole con una base forte, si può vedere che il cambiamento è più graduale.
In questo caso viene intitolato un acido debole, come l'acido acetico (CH3COOH) con una base forte, idrossido di sodio (NaOH). La reazione che si verifica nel grado può schematizzare come segue:
NaOH +CH3COOH => CH3COO-N / a+ + H₂o
In questo caso, la soluzione tampone acetata è formata con un PKA = 4,74. La regione ammortizzata può essere vista nel cambiamento leggero e quasi impercettibile prima del pH 6.
Può servirti: un gruppo amminico (NH2): struttura, proprietà, esempiIl punto di equivalenza, come indicato dall'immagine, è di circa 8,72 e non 7. Questo perché Cho3COO- È un anione che dopo Hydrolyzar genera oh-, che basa il pH:
Cap3COO- + H₂o ch3COOH +OH-
Fasi
La titolazione dell'acido acetico mediante idrossido di sodio può essere divisa in 4 fasi per l'analisi.
- Prima di iniziare ad aggiungere la base (NaOH), il pH della soluzione è acido e dipende dalla dissociazione dell'acido acetico.
- Quando viene aggiunta l'idrossido di sodio, si sta formando la soluzione di smorzamento dell'acetato, ma allo stesso modo la formazione della base di acetato coniugata, il che porta con sé un aumento della soluzione della soluzione della soluzione.
- Il pH del punto di equivalenza si verifica a un pH di 8,72, che è francamente alcalino.
Il punto di equivalenza non ha un valore costante e varia a seconda dei composti coinvolti nel grado.
- Continuando ad aggiungere NaOH, dopo aver raggiunto il punto di equivalenza, il pH sta aumentando a causa dell'eccesso di idrossido di sodio.
Selezione dell'indicatore in base al punto di equivalenza
La fenolftaleina è utile per determinare il punto di equivalenza in questo grado, perché ha il suo punto di svolta del colore in un pH intorno a 8, che cade nell'area del pH della titolazione dell'acido acetico che include l'equivalenza del punto (pH = 8,72).
D'altra parte, il rosso metile non è utile per determinare il punto di equivalenza, poiché cambia colore nell'intervallo di pH da 4,5 a 6,4.
Riferimenti
- Helmestine, Anne Marie. Definizione del punto di equivalenza. Recuperato da Thoughtco.com
- Differenza tra endpoint e punto di equivalenza. Estratto da differenza tra.netto
- Punto di equivalenza: definizione e calcolo. Studio recuperato.com

