Caratteristiche, applicazioni ed esempi del processo politico

- 1812
- 548
- Zelida Gatti
UN Processo politico È un processo termodinamico che si verifica quando la relazione tra pressione P e il volume V dato da P.VN Rimane costante. L'esponente N È un numero reale, generalmente tra zero e infinito, ma che in alcuni casi può essere negativo.
Il valore di N ricevere il nome di Indice politropico Ed è importante evidenziare che durante un processo termodinamico poltropico detto indice deve mantenere un valore fisso, altrimenti il processo non sarà considerato politropico.
 Figura 1. Equazione caratteristica di un processo termodinamico poltropico. Fonte: f. Zapata.
Figura 1. Equazione caratteristica di un processo termodinamico poltropico. Fonte: f. Zapata. [TOC]
Caratteristiche dei processi politropici
Alcuni casi caratteristici di processi politropici sono:
- Il processo isotermico (a temperatura costante t), in cui l'esponente è n = 1.
- Un processo isobarico (pressione costante p), in questo caso n = 0.
- Il processo isocorico (al volume V costante), per il quale n =+∞.
- Processi adiabatici (all'entropia costante), in cui l'esponente è n = γ, essendo γ la costante adiabatica. Questa costante è il quoziente tra la capacità termica a pressione costante CP divisa per la capacità termica al volume CV costante:
γ = cp/cv
- Qualsiasi altro processo termodinamico che non è uno dei casi precedenti. Ma rispettare P.VN = cTe Con indice poltropico reale e costante N Sarà anche un processo politropico.
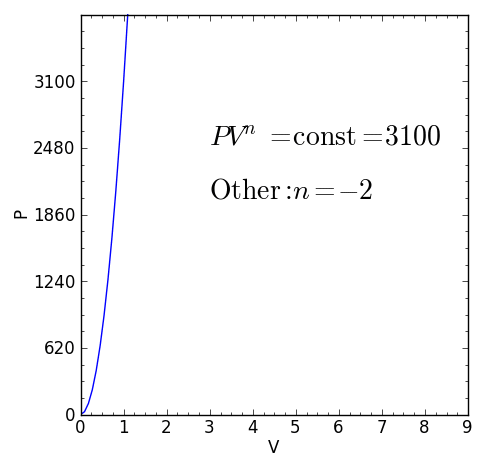 figura 2. Diversi casi caratteristici di processi termodinamici poltropi. Fonte: Wikimedia Commons.
figura 2. Diversi casi caratteristici di processi termodinamici poltropi. Fonte: Wikimedia Commons. Applicazioni
Una delle principali applicazioni dell'equazione poltropica è per il calcolo del lavoro svolto da un sistema termodinamico chiuso, quando passa da uno stato iniziale a un'altra estremità in un modo quasi statico, cioè dopo una successione di stati di equilibrio.
Lavorare in processi politropici per diversi valori di n
Per n ≠ 1
Il lavoro meccanico W eseguito da un sistema termodinamico chiuso è calcolato per espressione:
W = ∫p.Dv
Può servirti: diamagnetism: materiali, applicazioni, esempiDove p è la pressione e v il volume.
Come nel caso di un processo politropico, la relazione tra pressione e volume è:
P.V N = costante = c
Cancella p dell'espressione precedente per sostituirla nell'espressione del lavoro:
P = c /V N
Hai svolto il lavoro meccanico durante un processo politropico, che inizia in uno stato iniziale 1 e termina nello stato finale 2. Tutto ciò appare nella seguente espressione:

\left&space;[V_2^1-n-V_1^1-n&space;\right&space;])
C = p1 V1N = P2 V2N
Sostituendo il valore della costante nell'espressione del lavoro:
W = (p2 V2 - P1 V1)/(1-N)
Nel caso in cui la sostanza di lavoro possa essere modellata come un gas ideale, è avere la seguente equazione statale:
P.V = m.R.T
Dove m è il numero di moli di gas ideale e r è la costante universale dei gas.
Per un gas ideale che segue un processo politropico con un indice di politropia diverso dall'unità e che passa da uno stato con temperatura iniziale T1 a un altro stato con la temperatura t2 Il lavoro svolto è dato dalla seguente formula:
W = m r (t2 - T1)/(1-N)
Per n → ∞
Secondo la formula per il lavoro ottenuto nella sezione precedente, il lavoro di un processo politropico con n = ∞ è nullo, poiché l'espressione del lavoro è divisa tra l'infinito e quindi il risultato tende a zero.
Un altro modo per raggiungere questo risultato è iniziare dalla relazione P1 V1N = P2 V2N, che può essere riscritto come segue:
(P1/P2) = (V2/V1)N
Prendendo la radice N-THICKER in ogni membro che ottieni:
(V2/V1) = (P1/P2)(1/N)
Nel caso in cui N → ∞, devi (V2/V1) = 1, che significa che:
Può servirti: calore ceded: formule, come calcolarlo e risolvere eserciziV2 = V1
Cioè, il volume non cambia in un processo politropico con n → ∞. Pertanto il differenziale del volume DV nell'integrale del lavoro meccanico è 0. Questi tipi di processi politropici sono anche noti come processi isocorico, o processi a volume costante.
Per n = 1
Ancora una volta abbiamo l'espressione per il lavoro:
W = ∫p dv
Nel caso di un processo politropico con n = 1, la relazione tra pressione e volume è:
P v = costante = c
Cancellando P dell'espressione precedente e sostituendo, hai fatto il lavoro per passare dallo stato iniziale 1 allo stato finale 2:

Vale a dire:
W = c ln (V2/V1).
Poiché gli stati iniziali e finali sono ben determinati, anche il CTTE. Vale a dire:
C = p1 V1 = P2 V2
Infine, sono disponibili le seguenti espressioni utili per trovare il lavoro meccanico di un sistema chiuso poliitropico in cui n = 1.
W = p1 V1 ln (v2/V1) = P2 V2 ln (v2/V1)
Se la sostanza di lavoro è composta da M Moli di gas ideale, quindi è possibile applicare l'equazione del gas ideale: p v = m.R.T.
In questo caso, come P.V1 = CTTE, un processo politropico con n = 1 è un processo a temperatura T costante (isotermica), in modo da poter ottenere le seguenti espressioni per il lavoro:
W = m r t1 ln (v2/V1) = m r t2 ln (v2/V1)
 Figura 3. Uno scioglimento di caramban, esempio di processo isotermico. Fonte: Pixabay.
Figura 3. Uno scioglimento di caramban, esempio di processo isotermico. Fonte: Pixabay. Esempi di processi politropici
- Esempio 1
Assumi un cilindro con un pistone mobile pieno con un chilogrammo di aria. Inizialmente l'aria occupa un volume V1= 0,2 m3 A una pressione P1= 400 kPa. Un processo politropico è seguito con n = γ = 1,4, il cui stato finale ha la pressione P2 = 100 kPa. Determina il lavoro svolto dall'aria sul pistone.
Soluzione
Quando l'indice di politropia è uguale alla costante adiabatica, esiste un processo in cui la sostanza di lavoro (aria) non scambia calore con l'ambiente e quindi non cambia entropia.
Può servirti: terza legge della termodinamica: formule, equazioni, esempiPer l'aria, un gas diatomico ideale, hai:
γ = cp/cv, con cp = (7/2) r e cv = (5/2) r
COSÌ:
γ = 7/5 = 1.4
Usando l'espressione del processo politropico, è possibile determinare il volume finale dell'aria:
V2 = [P2 V11.4)/P2"(1/1.4) = 0,54 m3.
Ora ci sono condizioni per applicare la formula di lavoro svolta in un processo politropico per n ≠ 1 ottenuto sopra:
W = (p2 V2 - P1 V1)/(1-N)
Sostituire i valori appropriati sono:
W = (100 kPa 0,54 m3 - 400 kPa 0,2 m3)/(1 - 1.4) = 65,4 kJ
- Esempio 2
Assumi lo stesso cilindro dell'esempio 1, con un pistone mobile pieno con un chilogrammo di aria. Inizialmente l'aria occupa un volume v1 = 0,2 m3 A una pressione P1 = 400 kPa. Ma a differenza del caso precedente, l'aria si espande isotermicamente per raggiungere una pressione finale P2 = 100 kPa. Determina il lavoro svolto dall'aria sul pistone.
Soluzione
Come visto in precedenza, i processi isotermici sono processi politropici con indice n = 1, quindi è soddisfatto:
P1 V1 = P2 V2
In questo modo il volume finale può essere facilmente distaccato per ottenere:
V2 = 0,8 m3
Quindi usando l'espressione del lavoro precedentemente ottenuto per il caso n = 1 è necessario lavorare sull'aria sul pistone in questo processo è:
W = P1 V1 LN (V2/V1) = 400000 Pa × 0,2 m3 LN (0,8/0,2) = 110,9 kJ.
Riferimenti
- Bauer, w. 2011. Fisica per ingegneria e scienze. Volume 1. Mc Graw Hill.
- Cengel, e. 2012. Termodinamica. 7a edizione. McGraw Hill.
- Figueroa, d. (2005). Serie: Physics for Science and Engineering. Volume 4. Fluidi e termodinamica. A cura di Douglas Figueroa (USB).
- López, c. La prima legge della termodinamica. Recuperato da: Culturacientifica.com.
- Cavaliere, r. 2017. Fisica per scienziati e ingegneria: un approccio strategico. Pearson.
- Serway, r., Vulle, c. 2011. Fondamenti di fisica. 9na ed. Apprendimento del Cengage.
- Siviglia University. Macchine termiche. Recuperato da: Laplace.noi.È.
- Wikiwand. Processo politico. Recuperato da: wikiwand.com.
- « Studia di ricerca cosa sono, tipi ed esempi
- Delimitazione dell'argomento di ricerca ciò che consiste ed esempi »

