Tipi di processo adiabatici, esempi, esercizi risolti
- 3633
- 781
- Silvano Montanari
UN Processo adiabatico È quello in cui non esiste uno scambio di calore tra il sistema e l'ambiente circostante, sia perché si verifica all'interno di un mezzo isolante o perché passa molto rapidamente. Ciò significa che nei dintorni del sistema, questa è la parte dell'universo in studio, le variazioni di temperatura non dovrebbero essere percepite, ma solo funzionano.
Questo è uno dei processi elementari della termodinamica. A differenza degli altri processi (isocorici, isobari e isotermici), nessuna delle sue variabili fisiche rimane costante; Cioè, le magnitudini di pressione, volume, temperatura e entropia cambiano man mano che il processo adiabatico si evolve.
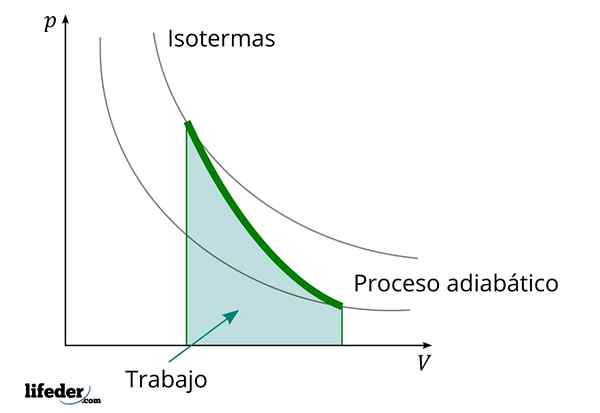
 Durante un processo adiabatico in cui aumenta il volume, l'energia interna della sostanza che il lavoro diminuisce
Durante un processo adiabatico in cui aumenta il volume, l'energia interna della sostanza che il lavoro diminuisce Un'altra caratteristica importante dei processi adiabatici è che svolgono o consumano un lavoro proporzionalmente alla variazione dell'energia interna dei loro sistemi; In questo caso, di quelli delle sue molecole in una fase gassosa. Questo può essere dimostrato grazie alla prima legge della termodinamica.
Nella vita quotidiana questo tipo di processo copre soprattutto i fenomeni geofisici e, in una certa misura, il funzionamento dei pistoni nei motori diesel. Il trasferimento di calore è spesso impedito con l'uso di un mezzo isolante, ma è la velocità di questi processi che consente il loro vero sviluppo.
[TOC]
Processi adiabatici reversibili e irreversibili
Reversibile
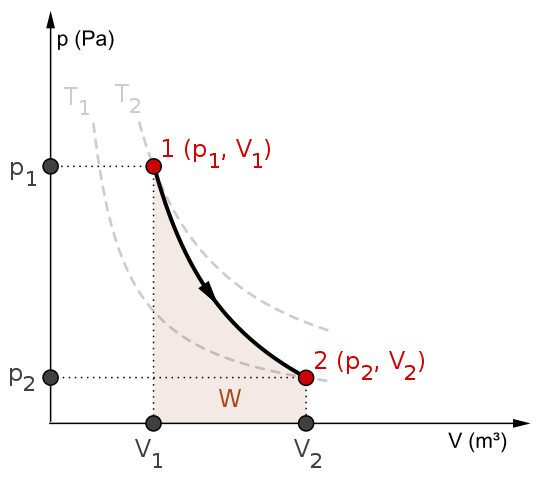 Diagramma p-V e lavoro W per un processo adiabatico. Fonte: Mikerun/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)
Diagramma p-V e lavoro W per un processo adiabatico. Fonte: Mikerun/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0) I processi adiabatici possono essere reversibili o irreversibili. Tuttavia, il primo esiste solo come strumenti teorici per studiare il secondo. Pertanto, i processi reversibili adiabatici coinvolgono i gas ideali e mancano di attrito e qualsiasi altra eventualità che provoca un trasferimento di calore tra il sistema e l'ambiente circostante.
Considera, ad esempio, il diagramma P-V per il processo adiabatico reversibile dall'alto. T1 e T2 corrispondere a due isoterme, su cui le pressioni P e i volumi V del sistema variano.
Tra gli stati (P1, V1) E p2, V2) Viene eseguita un'espansione adiabatica reversibile, poiché passiamo da un volume V1 a un v2, più grande, seguendo la direzione della freccia.
In tal modo, il sistema si raffredda, ma senza obbedire al comportamento delle isoterme. L'area sotto la curva corrisponde al lavoro W, il cui valore è positivo perché è un'espansione.
In questo processo l'entropia rimane costante e, quindi, si dice che sia isontropico. L'elaborazione matematica di questa reversibilità genera una serie di equazioni con cui è possibile valutare altri sistemi.
Può servirti: celle elettroliticheIrreversibile
I processi adiabatici irreversibili, a differenza di quelli reversibili, non sono grafici nei diagrammi P-V con linee continue ma tratteggiate, poiché solo gli stati finali e iniziali hanno le loro variabili (p, v e t) ben definite. Questi processi coinvolgono gas reali, quindi l'equazione dei gas ideali e le loro derivazioni non sono direttamente applicabili ad essi.
Passano rapidamente, impedendo il trasferimento di calore tra il sistema e l'ambiente circostante. Inoltre, in esse l'entropia aumenta, come indicato nella seconda legge della termodinamica.
Esempi di processi adiabatici
 La capacità isolante, come quella presentata da Thermos, è uno dei fattori chiave per un processo per sviluppare adiabaticamente
La capacità isolante, come quella presentata da Thermos, è uno dei fattori chiave per un processo per sviluppare adiabaticamente Di seguito saranno menzionati alcuni esempi di processi adiabatici.
Espansione e comprensione
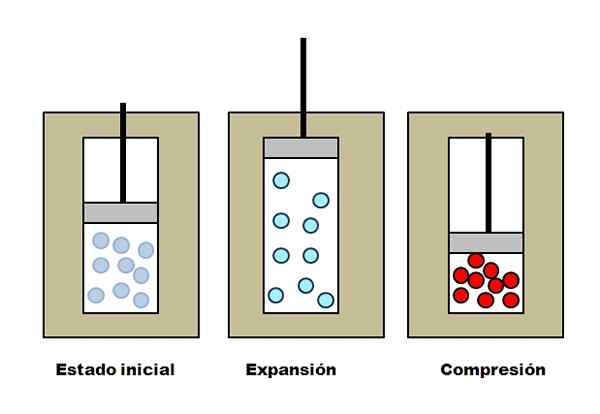 Espansione e comprensione adiabatica. Fonte: Gabriel Bolívar.
Espansione e comprensione adiabatica. Fonte: Gabriel Bolívar. Supponiamo che tre giubbotti isolanti contenenti compartimenti pieni di gas. In uno stato iniziale, il pistone non ha pressione sul gas. Quindi, il pistone può aumentare, il che aumenta il volume attraverso il quale le molecole di gas possono muoversi, causando una diminuzione della sua energia interna; E quindi, una diminuzione della temperatura.
Il contrario accade con la compressione adiabatica: il pistone svolge un lavoro sul gas, riducendo il volume che le sue molecole possono occupare. L'energia interna questa volta aumenta, il che implica anche un aumento della temperatura, il cui calore non può disperdersi verso l'ambiente circostante a causa del giubbotto isolante.
Ascent Magma
I canali in cui il magma si alza all'interno di un vulcano raccontano come un mezzo isolante, che impedisce il trasferimento di calore tra magma e atmosfera.
Il suono si diffuse
I gas sono disturbati e ampliati in base all'onda sonora senza raffreddamento o calda l'aria che li circonda.
Effetto foehn
L'effetto foehn è un esempio di processi adiabatici nel campo della geofisica. Le masse d'aria salgono verso la parte superiore di una montagna dove sperimentano meno pressione, quindi le loro molecole si espandono e si raffreddano, dando origine alla formazione della nuvola.
Tuttavia, scendono a malapena dall'altra parte della montagna, la pressione aumenta e, quindi, le molecole vengono compresse e aumentano la temperatura, facendo scomparire la nuvola.
Può servirti: clorobenzene (C6H5Cl)Nel seguente video questo fenomeno può essere apprezzato:
Esercizi risolti
Infine, verranno risolti un paio di esercizi. È importante avere le seguenti equazioni a portata di mano:
ΔU = Q - W (prima legge della termodinamica)
Ma non avendo trasferimento di calore, q = 0 y:
ΔU = - W (1)
Questo è: se il lavoro w è positivo, ΔU è negativo e viceversa. D'altra parte, abbiamo anche:
W = -NCVΔT (2)
Che dopo aver applicato l'equazione di gassa ideale (PV = NRt) e sostituire e risolvere per t2 e T1 avremo:
W = (cV/R) (p1V1 - P2V2) (3)
Essendo il valore di r uguale a 0.082 l · atm/mol · k o 8.314 J/mol · K
Nei processi adiabatici è importante conoscere la relazione CP/CV noto come γ:
γ = cP/CV (4)
Che consente di stabilire relazioni T-V e P-V:
T1V1γ-1 = T2V2γ-1 (5)
P1V1γ = P2V2γ (6)
E inoltre, le calore approssimative di CP e CV Variano a seconda che i gas siano monoatomici, diatomici, ecc.
Esercizio 1
Un gas esegue 600 J di lavoro attraverso un compartimento isolato. Qual è il cambiamento nella sua energia interna? La temperatura diminuisce o aumenta? E considerando che si tratta di un gas monoatomico, calcola anche γ.
Dati:
W = +600J
ΔU = ¿?
γ =?
Il lavoro è positivo perché il gas funziona su ciò che. Essere all'interno di un compartimento isolato, Q = 0, e quindi avremo l'equazione (1):
ΔU = - W
Cioè, ΔU è uguale a:
ΔU = - (+600J)
= -600J
Il che significa che l'energia interna del gas è diminuita di 600 j. Se ΔU diminuisce, anche la temperatura, quindi il gas si raffredda a causa di aver svolto il lavoro.
Perché questo gas è monoatomico,
CV = 3/2 r
CP = 5/2 r
Ed essere
γ = cP/CV
= (5/2 R)/(3/2 R)
= 5/3 o 1.66
Esercizio 2
In un contenitore 7 moli di O2 Sono stati compressi da un volume di 15 litri a 9 litri. Sapere che la temperatura iniziale era di 300 K, calcola: il lavoro svolto sul gas.
Dati:
N = 7 moli o2
T1 = 300 k
V1 = 15 l
V2 = 9 l
W = ¿?
È una comprensione adiabatica irreversibile. Abbiamo due equazioni da risolvere W:
W = -NCVΔT (2)
W = (cV/R) (p1V1 - P2V2) (3)
Le pressioni possono calcolarle, ma per risparmiare tempo è meglio procedere con la prima delle equazioni:
Può servirti: acqua distillataW = -NCVΔt
= -NCV (T2-T1)
Abbiamo bisogno di cV e T2 Per determinare w. L'ossigeno, essendo un gas diatomico, ha una CV uguale a 5/2 r:
CV (O2) = 5/2 r
= 5/2 (8.314 J/mol · K)
= 20.785 J/mol · K
Dobbiamo calcolare t2. Passiamo all'equazione (5):
T1V1γ-1 = T2V2γ-1
Ma prima di usarlo devi determinare il primo CP e γ:
CP (O2) = 7/2 r
= 7/2 (8.314 J/mol · K)
= 29.099 J/mol · K
Essere γ pari a:
γ = cP/CV
= (29.099 J / mol · K) / 20.785 J/mol · K
= 1.4
Quindi, possiamo chiarire questo2 Dall'equazione (5):
T1V1γ-1 = T2V2γ-1
T2 = (T1V1γ-1) / (V2γ-1)
= [(300K) (15L)1.4-1] / (9L)1.4-1
= 368.01 k
E infine risolviamo per W:
W = -NCVΔt
= -(7 mol o2)( venti.785 J/mol · K) (368.01 K - 300 K)
= -9895.11 j o -9.895 kJ
Esercizio 3
Un contenitore al neon si espande adiabatico e inizialmente a temperatura ambiente (t = 298k) da 12 L a 14 L. Sapendo che la sua pressione iniziale era di 3 atm, quello che sarà il lavoro svolto dal gas?
Dati:
T1 = 298 k
V1 = 12 l
V2 = 14 l
P1 = 3 atm
W = ¿?
L'equazione (3) ci consente di determinare W con i valori delle pressioni:
W = (cV/R) (p1V1 - P2V2)
Ma ci manca CV E p2.
La pressione finale può essere calcolata con l'equazione (6):
P1V1γ = P2V2γ
Essendo γ uguale a cP/CV. Poiché il neon è un gas monoatomico, abbiamo i suoi valori CP e CV Sono 5/2R e 3/2R, rispettivamente. Calcoliamo quindi γ:
γ = cP/CV
= (5/2r)/(3/2R)
= 5/3 o 1.66
Chiariamo p2 Dall'equazione (6):
P2 = (P1V1γ) / V2γ
= [(3 atm) (12 L)5/3] / (14 L)5/3
= 1.40 atm
E il lavoro sarà uguale a:
W = (cV/R) (p1V1 - P2V2)
= (3/2) [(3 atm) (12 l) - (1.40 atm) (14 L)] (101300 PA/1 ATM) (0.001 m3/L) (KJ/1000 J)
= 2.49 kJ
I fattori di conversione vengono utilizzati per convertire il l · atm a pa · m3, che è equivalente a 1 j. Il gas al neon si espande, quindi la sua pressione diminuisce e, quando svolge lavoro su ciò che è positivo, questo è positivo. Inoltre, la sua energia interna ΔU diminuisce, nonché la sua temperatura, il raffreddamento nel processo di espansione.
Riferimenti
- Walter J. Moore. (1963). Chimica fisica. In cinetica chimica. Quarta edizione, Longmans.
- Iran. Levine. (2009). Principi di fisica. Sesta edizione. Mc Graw Hill.
- Wikipedia. (2020). Processo adiabatico. Recuperato da: in.Wikipedia.org
- Jones, Andrew Zimmerman. (18 agosto 2020). Temidinamica: processo adiabatico. Recuperato da: Thoughtco.com
- DeVoe Howard & Neils Tom. (9 agosto 2020). Cambiamenti adiabatici. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- « Qual è l'equivalente meccanico del calore?
- Storia, ideologia, rappresentanti, conseguenze di Maderismo »

