Principio di Le Châtelier

- 1991
- 112
- Lino Lombardi
Qual è il principio di Le Châtelier?
Lui Principio di Le Châtelier È una regola generale che prevede l'effetto che i diversi fattori che influenzano l'equilibrio chimico hanno. In particolare, aiuta a prevedere in quale direzione una reazione in equilibrio si muoverà quando tale equilibrio è disturbato da un agente esterno.
Questo principio lo stabilisce:
"Quando un sistema in equilibrio è soggetto a un disturbo o una tensione esterna, il sistema reagisce nella direzione che gli consente di contrastare parzialmente tale disturbo".
Il disturbo è ben compreso:
- Un cambiamento nella concentrazione di uno qualsiasi dei reagenti.
- Un cambiamento nella concentrazione di uno qualsiasi dei prodotti.
- Cambia di pressione.
- Cambiamenti di volume.
- Un cambiamento di temperatura
Quando si verificano cambiamenti come quelli menzionati, una delle due reazioni, la diretta o l'inversa, è favorita rispetto all'altra, in modo che il sistema reagisca in quel senso muoversi verso un nuovo stato di equilibrio.
Questo è simile agli aggiustamenti apportati da un bilanciatore sul corridoio. Quando la gravità hala da un lato, il bilanciatore reagisce spostandosi sul lato opposto. Diciamo che il suo equilibrio si è mosso, dal momento che è ancora in equilibrio (non cade), ma ora ha una posizione diversa.
Successivamente, vedremo come viene utilizzato il principio di Le Châtelier per prevedere la direzione in cui un sistema reagirà subendo diversi tipi di tensioni o disturbi come: variazioni di concentrazione, volume, pressione e temperatura.
Effetto dei cambiamenti nella concentrazione
Supponiamo di avere la seguente reazione in equilibrio:
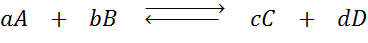
Se cambiamo la concentrazione di una qualsiasi delle specie coinvolte (A, B, C o D), il principio di Le Châtelier prevede che il sistema reagirà per contrastare questa modifica consumando l'eccesso aggiunto o il recupero della quantità eliminata. 4 diverse situazioni possono essere fornite:
1. Aumento della concentrazione di reagenti
Se aumentiamo la concentrazione di un reagente, ad esempio, a, secondo il principio di Le Châtelier, il sistema reagirà per consumare l'eccesso aggiunto. Ciò significa che reagirà direttamente (da sinistra a destra), poiché questa direzione viene consumata.
In questo caso si dice che la reazione diretta sia favorita e che l'equilibrio si è mosso verso i prodotti, poiché a New Balance la concentrazione di prodotti è maggiore di quella nell'equilibrio originale.
Può servirti: separazione magnetica2. Aumentata concentrazione di prodotti
Se aumentiamo la concentrazione di un prodotto, ad esempio C, il sistema reagirà al contrario per consumare l'eccesso C aggiunto (cioè da destra a sinistra).
In questo caso si dice che la reazione inversa sia favorita e che l'equilibrio si muova verso i reagenti.
3. Diminuzione della concentrazione di reagente
La diminuzione della concentrazione ha l'effetto opposto all'aumento della concentrazione. Se ritiriamo dal mezzo, riducendo così la sua concentrazione, il sistema reagirà a sinistra (al contrario) per contrastare il cambiamento. L'equilibrio si sposta verso i reagenti.
4. Diminuzione della concentrazione di prodotti
Se diminuiamo la concentrazione di C o D, il sistema reagirà direttamente per sostituire la concentrazione ridotta (cioè da sinistra a destra). L'equilibrio si sposta verso i prodotti.
Esempio:
Determina l'effetto dell'aggiunta di più ioni tiocianati (SCN-) Nel seguente equilibrio chimico, sapere che il prodotto della destra è intenso rosso e ferro (III) è giallo.
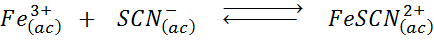
Soluzione: In questo caso, stiamo aggiungendo tiociata che è un reagente, quindi l'equilibrio deve spostarsi a destra, aumentando la concentrazione del complesso e, quindi, l'intensità del colore rosso nella soluzione.
Effetto delle variazioni del volume e della pressione
Le variazioni del volume e della pressione non influiscono significativamente sulle reazioni nell'equilibrio in stato liquido o solido, ma possono influenzare quelli che si trovano in uno stato gassoso. Questo perché, per i gas, la concentrazione è proporzionale alla pressione, come previsto dalla legge sui gas ideali.
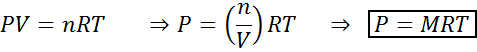
L'aumento della pressione di un gas mantenendo la temperatura costante è equivalente a diminuire il suo volume, quindi l'effetto di entrambi i disturbi sarà lo stesso.
Se una pressione totale aumenta a una reazione di bilanciamento negli equilibri (o ne diminuiamo il volume), il sistema reagirà cercando di ridurre nuovamente tale pressione, quindi l'equilibrio si sposterà dove vi è una quantità minore di molecole di particelle gassose.
Può servirti: cromatografia a strati fine: caratteristiche, a cosa serve Nella reazione tra azoto e idrogeno per formare ammoniaca, vengono consumate 4 molecole di soda e vengono prodotte solo due, quindi un aumento della pressione sposta l'equilibrio verso la maggior formazione di ammoniaca
Nella reazione tra azoto e idrogeno per formare ammoniaca, vengono consumate 4 molecole di soda e vengono prodotte solo due, quindi un aumento della pressione sposta l'equilibrio verso la maggior formazione di ammoniaca Se nella reazione vengono consumati e vengono prodotti lo stesso numero di molecole di gas, le variazioni del volume e della pressione non influenzeranno l'equilibrio.
D'altra parte, se modifichiamo solo la pressione parziale di uno qualsiasi dei gas, l'effetto è lo stesso che aumentare o ridurre la concentrazione di detta specie.
Esempio:
Data la reazione di decomposizione del tetroxide dyitrogen in equilibrio:
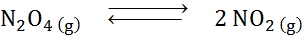
Determina l'effetto della riduzione del volume, aumentando la pressione.
Soluzione: Se aumentiamo la pressione totale del sistema o ne riduciamo il volume, l'equilibrio si sposta verso i reagenti, poiché, in quella direzione, c'è una riduzione netta delle molecole di gas (2 e 1) viene consumata 1) che consente di contrastare l'aumento dell'assistenza.
Effetto delle variazioni di temperatura
L'effetto della temperatura sull'equilibrio chimico è diverso dagli altri fattori che abbiamo visto finora. Nei casi precedenti, dopo il disturbo si ottiene un nuovo equilibrio, ma viene mantenuta la stessa costante di equilibrio. Tuttavia, se la temperatura cambia, la costante di equilibrio cambierà.
Per sapere come i cambiamenti costante di equilibrio con la temperatura, il segno dell'entalpia di reazione deve essere conosciuto:
- Se una reazione rilascia calore, cioè è esotermica, la sua entalpia è negativa e la costante di equilibrio diminuisce all'aumentare della temperatura. In questi casi, l'equilibrio si muove nella direzione opposta verso i reagenti.
- Se una reazione assorbe il calore, cioè è endotermico, la sua entalpia è positiva e il contrario accade.
Ricordare l'effetto della temperatura è facile se consideriamo il calore come un reagente che si verifica nel caso di reazioni esotermiche e viene consumato in caso di endotermica. L'aumento della temperatura sarebbe come "aggiungere" il calore al sistema e raffreddarli sarebbe equivalente a rimuoverlo.
Quindi, se una reazione è esotermica e la temperatura è aumentata, sarebbe come aggiungere un prodotto della reazione, quindi l'equilibrio si muove nella direzione opposta, verso i reagenti e se raffredda il contrario.
Può servirti: acido píchric: cosa è, struttura, sintesi, proprietàD'altra parte, se una reazione è endotermica e la temperatura è aumentata, sarebbe come aggiungere un reagente, quindi l'equilibrio si sposta verso i prodotti, mentre una diminuzione della temperatura ha l'effetto opposto.
Esempio:
La reazione di decomposizione di n2O4 Ha un'entalpia di reazione di +58,0 kJ/mol. In quale direzione si muoverà l'equilibrio se la temperatura è diminuita?
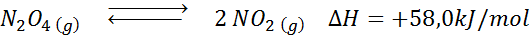
Soluzione: Poiché l'entalpia è positiva, la reazione è endotermica. Per questo motivo, il raffreddamento favorirà la reazione inversa e l'equilibrio si muoverà verso i reagenti, cioè verso la formazione di più n2O4.
Effetto di catalizzatori, inibitori e sostanze inerte
I catalizzatori e gli inibitori influenzano la velocità con cui si verificano le reazioni, ma influenzano la reazione sia diretta che indiretta. Per questo motivo, non influiscono sullo stato di equilibrio.
D'altra parte, l'aggiunta di una sostanza inerte come gas che non reagisce con nessuno dei reagenti o prodotti, non influenzerà la reazione diretta o diretta, quindi avrà alcun effetto sull'equilibrio.
Applicazione del principio di Le Châtelier
Comprendere questo principio è molto utile, poiché ci consente di manipolare lo stato di equilibrio di una reazione alla nostra comodità.
In quei casi in cui siamo interessati.
Questo significa:
- Aggiungi grandi quantità di reagenti, se questi sono economici.
- Ritirare il prodotto man mano che la reazione avanza, al fine di mantenere il sistema in costante stato di tensione, cercando sempre di raggiungere l'equilibrio reagendo direttamente.
- Aumentare la temperatura nel caso delle reazioni endotermiche.
- Aumenta la pressione su quelle reazioni in cui vengono consumate più molecole di gassa.
Potremmo anche voler ridurre al minimo la quantità di un prodotto formato da una reazione indesiderata. In questi casi facciamo il contrario.
Esempio di applicazione del principio di Le Châtelier
Nella sintesi organica il principio di Le Châtelier viene costantemente utilizzato per migliorare le rese delle reazioni.
Ad esempio, nelle reazioni di disidratazione dell'alcool, gli essiccanti vengono aggiunti all'ambiente che assorbono l'acqua formata durante la reazione. Ciò riduce la concentrazione di detto prodotto, che sposta l'equilibrio verso i prodotti.

