Precipitato

- 3200
- 572
- Lino Lombardi
Spieghiamo cosa è un precipitato, la reazione di precipitazione, i tipi che esistono e danno diversi esempi
 Formazione di precipitato giallo durante la miscelazione di una soluzione con un agente precipitante
Formazione di precipitato giallo durante la miscelazione di una soluzione con un agente precipitante Cos'è un precipitato?
UN precipitato È un solido che si forma da una soluzione, sia dalla cristallizzazione di una sostanza disciolta o dalla formazione di una sostanza insolubile attraverso una reazione chimica.
Il primo caso si verifica quando una sostanza solida, che è stata inizialmente sciolta in un solvente come l'acqua, diventa meno solubile. Questo può accadere quando:
- La temperatura della soluzione è ridotta.
- Viene aggiunto un agente precipitante.
- Viene aggiunto un altro solvente in cui il solido è meno solubile.
Quando la sua solubilità diventa inferiore alla sua concentrazione, la soluzione diventa sovrasaturata e si verifica una reazione di precipitazione.
Il secondo caso si verifica dopo qualsiasi reazione chimica che genera un prodotto solubile insolubile o molto piccolo nel solvente. Una volta che questo prodotto inizia a formarsi, la soluzione è rapidamente satura e il solido inizia a precipitare.
Reazione di precipitazione chimica
La reazione di precipitazione è il processo chimico che porta alla formazione di un precipitato. A seconda di come si forma il precipitato, la reazione può essere scritta in due modi diversi:
- Se la precipitazione si verifica perché la solubilità del solido nel solvente è stata ridotta (raffreddamento o aggiunta di un altro solvente, per esempio), allora la reazione di precipitazione coinvolge solo il soluto e sembrerebbe questo:

Per esempio, Se l'acetato di sodio si dissolve (CH-3Tasca) in acqua calda e quindi lasciato raffreddare, l'acetato di sodio precipiterà in base alla seguente equazione:

- Se si verifica la precipitazione perché è stato aggiunto un agente precipitante, la reazione di precipitazione coinvolgerà sia il soluto che l'agente precipitante.
Per esempio, Ioni d'argento (AG+) Possono precipitare da una soluzione di nitrato d'argento (AGNO3) Aggiunta di una soluzione di cloruro di sodio o NaCl (agente precipitante). La reazione di precipitazione in questo caso è data da:
Può servirti: cloruro di nichel (NICL2): struttura, proprietà, ottenimento, usi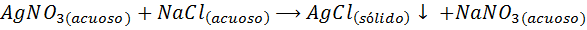
Meccanismo di precipitazione
Indipendentemente dalla reazione di precipitazione, la formazione del precipitato si verifica sempre in due fasi chiamati nucleazione e crescita:
-
Nucleazione
All'inizio della reazione di precipitazione, si formano piccole particelle di precipitato che sono chiamate nuclei, quindi questa fase è chiamata nucleazione.
-
Crescita
Dopo la nucleazione, non si formano più nuove particelle, ma i nuclei già formati iniziano a crescere fino a quando le precipitazioni si fermano.
Tipi di precipitato
La velocità con cui si formano i precipitati influisce sulla dimensione delle particelle solide e le proprietà delle stesse. A seconda delle dimensioni delle particelle e della natura del composto che è precipitante, si possono distinguere tre tipi di precipitati:
Precipitati cristallini
È il tipo più semplice di precipitato. In questo caso, il precipitato è costituito da grandi particelle solide con un diametro maggiore di 0,1 micrometri.
 Precipitato cristallino di solfato di rame (II) pentaidrato
Precipitato cristallino di solfato di rame (II) pentaidrato I precipitati cristallini si formano quando la reazione di precipitazione si verifica lentamente. Ciò consente a poche particelle solide di formarsi durante la nucleazione e ciascuna di queste particelle ha abbastanza tempo per crescere e formare cristalli grandi e pesanti che cadono sul fondo della soluzione.
Queste particelle sono quasi sempre solidi cristallini con facce piatte e luminose, simili alle sfaccettature di un diamante, e possono quasi sempre essere distinte con gli occhi nudi.
Precipitati casei
Sono precipitati per particelle molto più piccole, tra 0,01 e 0,1 micrometri di diametro. Questo tipo di precipitato si forma quando la reazione di precipitazione si verifica molto rapidamente, generando molte particelle durante la nucleazione che non hanno tempo per crescere.
A causa delle loro dimensioni, queste particelle sono molto leggere e sono sospese nella soluzione che formano un colloide stabile. Per questo motivo, non si accumulano nella parte inferiore della soluzione e sembra nuvoloso invece che trasparente.
Può servirti: diidrossicetone: struttura, proprietà, ottenimento, usi Tre caseosos di colori diversi. Le tre soluzioni sono oscure dopo la formazione dei precipitati
Tre caseosos di colori diversi. Le tre soluzioni sono oscure dopo la formazione dei precipitati Inoltre, le particelle sono così piccole che riescono ad attraversare la maggior parte dei filtri che vengono utilizzati per separare i precipitati dalle soluzioni.
Jellyry HaCords
Quando le particelle sono persino più piccole di quelle dei precipitati casei, cioè con diametri inferiori a 0,01 micrometri, i precipitati sono chiamati gelatina. Il motivo è perché il solido acquisisce un aspetto simile alla gelatina o a una marmellata.
Questi precipitati sono anche considerati colloidi. In effetti, la gelatina è un tipico esempio di colloide e questi precipitati prendono il loro nome dallo stesso.
Esempi caratteristici di gelatina precipitosi sono gli ossidi idratati di alcuni metalli. Questi ossidi assorbono una grande quantità di acqua sulla loro superficie che impedisce di formare particelle più grandi che si cristallizzano.
Esempi precipitati
Acetato di sodio (CH3Tasca)
Come accennato in precedenza, l'acetato di sodio può essere precipitato da una soluzione saturata a caldo che è consentito raffreddare. Se è consentito raffreddare lentamente, si forma un precipitato cristallino in cui si osservano cristalli di ago bianco lungo.
Solfuro di cadmio (II) (CDS)
Il solfuro di cadmio è un sale molto insolubile che viene immediatamente miscelato in una soluzione di ione cadmio (II) con un'altra che contiene ioni solfuri.
Rame solfato (II) pentaidrato (CUO4.5h2O)
Quando lo dissolve in acqua, il solfato di rame (II) forma ioni idratati di blu intenso. Se l'acqua evapora lentamente, precipita bellissimi cristalli blu di cuso4.5h2O. Questi cristalli sembrano pietre preziose.
Silver Bromide (AGBR)
Questo è un esempio di un composto che precipita molto velocemente formando un precipitato con particelle molto sottili che sono difficili da filtrare.
Può servirti: peso equivalenteOssido idratato in alluminio (III) (a2O3.NH2O)
Questo è un classico esempio della formazione di un precipitato gelatinoso. Si forma quando una soluzione di nitrato in alluminio (no (no3)3).
Manganese Solfuro (II) (MNS)
Molti solfuri sono insolubili in acqua e il solfuro di manganese non fa eccezione. Questo precipita sotto forma di una polvere molto fine.
Cloruro d'argento (AGCL)
Ioni d'argento (i) formano pochissimi sali solubili con tutti gli alogeni. Il caso del cloruro d'argento è un classico esempio di formazione precipitata in laboratorio.
Carbonato di calcio (Caco3)
Il calcio è uno degli ioni responsabili della durezza dell'acqua. Quando l'acqua che contiene il calcio viene riscaldata, reagisce formando carbonato di calcio che precipita sotto forma di uno strato bianco chiamato tartaro, che è persino in grado di ostacolare i tubi.
Ossido idratato di ferro (III) (Faith2O3.NH2O)
Questo è un altro esempio di un precipitato gelatinoso che è formato dalla reazione di una soluzione contenente ioni di ferro (III) con sodio o idrossido di potassio.
Idrossido di magnesio (mg (OH)2)
Il magnesio è l'altro cationi responsabile della durezza dell'acqua, poiché può precipitare sotto forma di idrossido di magnesio nei tubi e in altri sistemi di riscaldamento dell'acqua.
Riferimenti
- Bancoft, w. D. (1918). Contorno della chimica colloide.-Iii. Diario del Franklin Institute, 185(3), 373-387. https: // doi.org/10.1016/S0016-0032 (18) 90710-6
- CIVAN, f. (2007). Cressione cristallina e formazione di scala nei media porosi. Danno di formazione del serbatoio, 235-255. https: // doi.org/10.1016/B978-075067738-7/50010-5
- Skoog, d. A., Ovest, d. M., Holler, f. J., & Crouch, s. R. (2013). Fondamenti di chimica analitica. New York City, New York: Cengage Learning.
- Collaboratori di Wikipedia. (2021, 10 gennaio). Precipitazione (chimica). Recuperato da.Wikipedia.org

