Polarità (chimica) cosa è, definizione, esempi
- 3130
- 587
- Dott. Rodolfo Gatti
Cos'è la polarità chimica?
IL Polarità chimica È una proprietà che è caratterizzata dalla presenza di una marcata distribuzione eterogenea delle densità elettroniche in una molecola. Nella sua struttura, quindi, esistono regioni caricate negativamente (Δ-) e altre caricate positivamente (Δ+), generando un momento di dipolo.
Il momento dipolo (µ) di collegamento è una forma di espressione della polarità di una molecola. Di solito è rappresentato come un vettore la cui origine è nel carico (+) e la sua estremità si trova nel carico (-), sebbene alcuni prodotti chimici lo rappresentino al contrario.
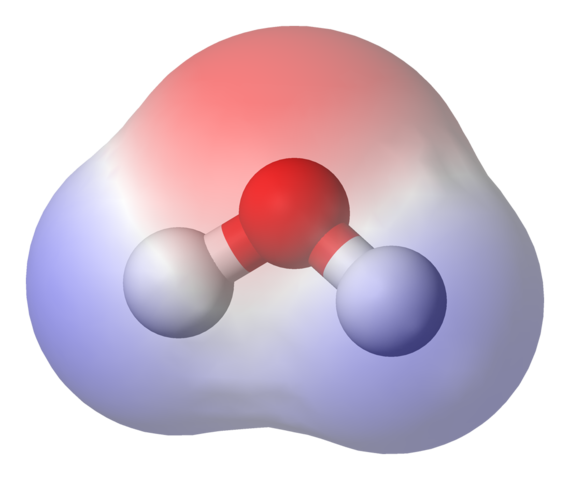
 Mappa potenziale elettrostatica per la molecola d'acqua. Fonte: Benjah-BMM27 via Wikipedia.
Mappa potenziale elettrostatica per la molecola d'acqua. Fonte: Benjah-BMM27 via Wikipedia. Nell'immagine superiore viene mostrata la mappa potenziale elettrostatica per l'acqua, h2O. La regione rossastra (atomo di ossigeno) corrisponde a quella con la più alta densità elettronica e si può anche vedere che si distingue sulle regioni blu (atomi di idrogeno).
Poiché la distribuzione di detta densità elettronica è eterogenea, si dice che esista un palo positivo e negativo. Ecco perché parliamo di polarità chimica e per il momento dipolo.
Momento dipolare
Il momento dipolo µ è definito dalla seguente equazione:
µ = Δ ·D
Dove Δ è la carica elettrica di ciascun polo, positivo (+Δ) o negativo (-Δ) e D È la distanza tra loro.
Il momento di dipolo è solitamente espresso in Debye, rappresentato dal simbolo d. Una metropolitana di Coulomb è equivalente a 2.998 · 1029 D.
Il valore del momento dipolo del legame tra due atomi diversi è in relazione alla differenza nelle elettronegatività degli atomi che formano il collegamento.
Perché una molecola sia polare, non è sufficiente avere collegamenti polari nella sua struttura, ma deve anche avere una geometria asimmetrica; In tal modo, ciò impedisce ai momenti di dipolo di annullarsi a vicenda.
Può servirti: carbroids: elementi, caratteristiche e usiAsimmetria nella molecola d'acqua
La molecola d'acqua ha due legami O-H. La geometria della molecola è angolare, cioè con la forma di "V"; Quindi i momenti dipolo dei collegamenti non si annullano a vicenda, ma la somma di essi si verifica indicando l'atomo di ossigeno.
La mappa potenziale elettrostatica per H2O riflettere questo.
Se si osserva la molecola angolare H-O-H, può sorgere la seguente domanda: è davvero asimmetrica? Se viene disegnato un asse immaginario che attraversa l'atomo di ossigeno, la molecola sarà divisa in due metà uguali: H-O | O-H.
Ma non è così se l'asse immaginario è orizzontale. Quando questo asse ora divide di nuovo la molecola in due metà, l'atomo di ossigeno avrà da un lato, e dall'altro i due atomi di idrogeno.
Ecco perché l'apparente simmetria di H2O cessa di esistere, e quindi viene considerata una molecola asimmetrica.
Molecole polari
Le molecole polari devono soddisfare una serie di caratteristiche, come:
-La distribuzione delle cariche elettriche nella struttura molecolare è asimmetrica.
-Di solito sono solubili in acqua. Ciò è dovuto tra le molecole polari può interagire per le forze dipolo-dipolo, dove l'acqua è caratterizzata da un grande momento di dipolo.
Inoltre, la sua costante dielettrica è molto elevata (78,5), che consente di mantenere carichi elettrici separati aumentando la sua solubilità.
-In generale, le molecole polari hanno alti punti di ebollizione e fusione.
Queste forze sono costituite dall'interazione dipolo-dipolo, dalle forze dispersive di Londra e dalla formazione di ponti idrogeno.
Può servirti: solfato di ferro (FESO4): cosa è, struttura, proprietà, sintesi-A causa della sua carica elettrica, le molecole polari possono guidare l'elettricità.
Esempi
SW2
Biossido di zolfo (così2). L'ossigeno ha un'elettronegatività di 3,44, mentre l'elettronegatività dello zolfo è 2,58. Pertanto, l'ossigeno è più elettronegativo dello zolfo. Esistono due collegamenti s = O, con o un carico Δ- e s a carico Δ+.
Poiché è una molecola angolare con la s nel vertice, i due momenti di dipolo sono orientati nella stessa direzione; E quindi, si sommano, rendendo così molecola2 Sii polare.
CHCL3
Cloroformio (HCCL3). C'è un collegamento C-H e tre collegamenti C-CL.
L'elettronegatività di C è 2,55 e l'elettronegatività di H è 2,2. Pertanto, il carbonio è più elettronegativo dell'idrogeno; E quindi, il momento del dipolo sarà orientato da H (Δ+) a C (Δ-): cΔ--HΔ+.
Nel caso dei collegamenti C-CL, la C ha un'elettronegatività di 2,55, mentre il CL ha un'elettronegatività di 3,16. Il momento di dipolo o dipolo è orientato dalla C al CL nei tre collegamenti C Δ+-Cl Δ-.
Quando c'è una povera regione di elettroni, attorno all'atomo di idrogeno e una regione ricca di elettroni costituiti dai tre atomi di cloro, il CHCL3 È considerata una molecola polare.
HF
Il fluoruro di idrogeno ha un solo legame H-F. L'elettronegatività di H è 2,22 e l'elettronegatività della F è 3,98. Pertanto, il fluoro termina con la più grande densità elettronica e il collegamento tra entrambi gli atomi è meglio descritto come: HΔ+-FΔ-.
Può servirti: idrossido di alluminio: struttura, proprietà, usi, rischiNH3
L'ammoniaca (NH3) ha tre collegamenti N-H. L'elettronegatività della N è 3.06 e l'elettronegatività di H è 2,22. Nei tre legami, la densità elettronica è orientata verso l'azoto, essendo ancora maggiore dalla presenza di una coppia di elettroni liberi.
La molecola NH3 È tetraedrico, con l'atomo di n che occupa il vertice. I tre momenti di dipolo, corrispondenti ai collegamenti N-H, sono orientati nella stessa direzione. In essi, Δ- si trova in N e Δ+ in H. Pertanto, i collegamenti sono: nΔ--HΔ+.
Questi momenti di dipolo, l'asimmetria della molecola e la coppia priva di elettroni su azoto, rendono l'ammoniaca una molecola altamente polare.
Macromolecole con eteroátomos
Quando le molecole sono molto grandi, non è più accurato classificarle come apolare o polare in sé. Questo perché potrebbero esserci parti della sua struttura con entrambe le caratteristiche apolari (idrofobiche), come le caratteristiche polari (idrofili).
Questi tipi di composti sono noti come anfifilos o anfipatici. Poiché la parte apolare può essere considerata scarsa negli elettroni rispetto alla parte polare, c'è una polarità presente nella struttura e i composti anfiprilici sono considerati composti polari.
Si può prevedere in generale che una macromolecola con eteroatomi abbia momenti di dipolo e, con esso, polarità chimica.
Eteroátomos è compreso da quelli che sono diversi da quelli che compongono lo scheletro della struttura. Ad esempio, lo scheletro carbonizzato è biologicamente il più importante di tutti e l'atomo con cui il carbonio (oltre all'idrogeno) si collega, si chiama eteroátomo.
Riferimenti
- Composti polari e non polari. St. Louis Community College. Recuperati da: utenti.STLCC.Edu
- Come spiegare la polarità. Scientifico. Recuperato da: scientifici.com

