Caratteristiche, struttura, funzioni, esempi di ossidorredottasi
- 2475
- 42
- Dott. Rodolfo Gatti
IL ossidorredottasi Sono proteine con attività enzimatica che si occupano di catalizzare le reazioni della riduzione della ruggine, cioè reazioni che implicano la rimozione di atomi di idrogeno o elettroni nei substrati su cui agiscono.
Le reazioni catalizzate da questi enzimi, come suggerisce il nome, sono reazioni di riduzione dell'ossido, cioè reazioni in cui una molecola dona elettroni o atomi di idrogeno e un'altra li riceve, cambiando i loro rispettivi stati di ossidazione.
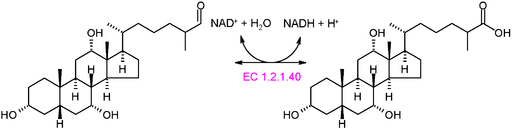 Schema grafico della reazione di un'ossidortasi di tipo EC 1.2.1.40 (Fonte: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons)
Schema grafico della reazione di un'ossidortasi di tipo EC 1.2.1.40 (Fonte: Akane700 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] via Wikimedia Commons) Esempio di enzimi ossidortici molto comuni in natura è quello delle deidrogenasi e delle ossidasi. Potrebbe essere menzionato all'enzima dell'alcol deidrogenasi, che catalizza la deidrogenazione dell'etanolo per produrre acetaldeide in una reazione NAD+ dipendente o inversa, per produrre etanolo durante la fermentazione alcolica effettuata da alcuni lieviti commercialmente importanti.
Gli enzimi della catena del trasportatore di elettroni nelle cellule aerobiche sono ossidorti responsabili del pompaggio dei protoni, quindi generano il gradiente elettrochimico attraverso la membrana mitocondriale interna che consente di aumentare la sintesi di ATP.
[TOC]
Caratteristiche generali
Gli enzimi ossidoreductasi sono enzimi che catalizzano l'ossidazione di un composto e la riduzione concomitante di un altro.
Questi normalmente richiedono la presenza di diversi tipi di coenzimi per il loro funzionamento. I coenzimi svolgono la funzione di donazione o accettazione.
Questi coenzimi possono essere la coppia NAD+/NADH o la coppia FAD/FADH2. In molti sistemi metabolici aerobici, questi elettroni e atomi di idrogeno vengono infine trasferiti dai coenzimi coinvolti all'ossigeno.
Sono enzimi con una "mancanza" pronunciata di specificità del substrato, permettendo loro di catalizzare le reazioni di cross -rise in diversi tipi di polimeri, che si tratti di proteine o carboidrati.
Classificazione
Molte volte, la nomenclatura e la classificazione di questi enzimi si basano sia sul substrato principale che usano sia sul tipo di coenzima di cui hanno bisogno per funzionare.
Secondo le raccomandazioni del comitato nomenclatura dell'Unione internazionale per la biochimica e la biologia molecolare (NC-IBMB), questi enzimi appartengono alla classe E.C. 1 e includi più o meno 23 tipi diversi (E.C.1.1-e.C.1.23), che sono:
Può servirti: eritropoietina (EPO): caratteristiche, produzione, funzioni- E.C. 1.1: quale atto nei gruppi di donatori CH-OH.
- E.C. 1.2: quale atto nel gruppo aldeide o nel gruppo di donatori Oxo de los.
- E.C. 1.3: che agiscono nei gruppi di donatori CH-CH.
- E.C. 1.4: che agiscono nei gruppi di donatori CH-NH2.
- E.C. 1.5: quale atto nei gruppi di donatori CH-NH.
- E.C. 1.6: quale atto in NADH o NADPH.
- E.C. 1.7: che agiscono su altri composti di azoto come i donatori.
- E.C. 1.8: che agiscono sui gruppi di zolfo di donatori.
- E.C. 1.9: quale atto nei gruppi di hoMo di donatori.
- E.C. 1.10: che agiscono in donatori come difenoli e altre sostanze correlate.
- E.C. 1.11: che agiscono sul perossido come accettore.
- E.C. 1.12: che agiscono sull'idrogeno come donatore.
- E.C. 1.13: che agiscono su semplici donatori con l'incorporazione di ossigeno molecolare (ossigenasi).
- E.C. 1.14: che agiscono su donatori "accoppiati", con l'incorporazione o la riduzione dell'ossigeno molecolare.
- E.C. 1.15: che agiscono sui superossidi come accettori.
- E.C. 1.16: quali ossidare ioni metallici.
- E.C. 1.17: quale atto sui gruppi CH2.
- E.C. 1.18: che agiscono su proteine che contengono ferro e assumono come donatori.
- E.C. 1.19: che agiscono sulla ridotta flavodossina come donatore.
- E.C. 1.20: che agiscono su donatori come fosforo e arsenico.
- E.C. 1.21: che agiscono nella reazione x-h + y-h = x-y.
- E.C. 1.22: quale atto sull'alogeno dei donatori.
- E.C. 1.23: che riducono i gruppi C-O-C come accettori.
- E.C. 1.97: altre ossidorioduttasi.
Ognuna di queste categorie include anche sottogruppi in cui gli enzimi sono separati in base alla preferenza dei substrati.
Può servirti: successione primaria: caratteristiche ed esempiAd esempio, all'interno del gruppo di ossidoreduttasi che agiscono sui gruppi CH-OH dei loro donatori ci sono alcuni che preferiscono NAD+ o NADP+ come accettori, mentre altri usano citocromi, ossigeno, zolfo, ecc.
Struttura
Poiché il gruppo di ossidoreduttasi è estremamente vario, stabilire una caratteristica strutturale definita è piuttosto complicato. La sua struttura non solo varia da enzima all'enzima, ma anche tra specie o gruppo di esseri viventi e persino cellule a cellule in diversi tessuti.
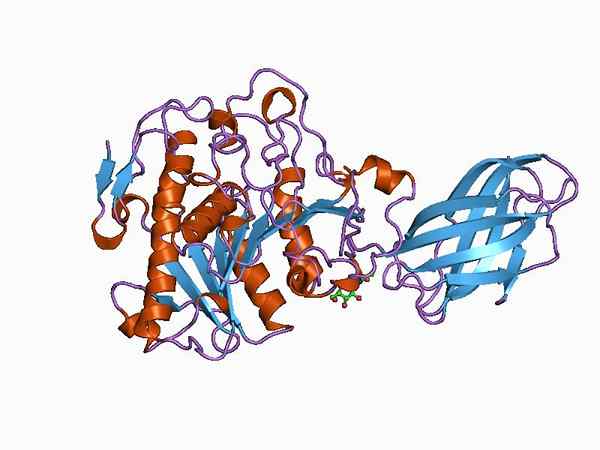
 Modello bioinformatico della struttura di un enzima ossiduttasi (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Public Domain] tramite Wikimedia Commons)
Modello bioinformatico della struttura di un enzima ossiduttasi (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Public Domain] tramite Wikimedia Commons) L'enzima piruvato deidrogenasi, ad esempio, è un complesso composto da tre subunità catalitiche sequenzialmente collegate e noto come subunità E1 (deidrogenasi piruvata), subunità E2 (diidrolipamide acetiltransferasi) e la subunità E3 (diidrolipamide deidrogenasi).
Ognuna di queste subunità, a sua volta, può essere composta da più di un monomero proteico dello stesso tipo o di diversi tipi, cioè possono essere omodimerici (quelli con solo due monomeri uguali), eterotrimérica (che hanno tre monomeri diversi) e così via.
Tuttavia, di solito sono enzimi composti da fogli alfa e β disposti in modi diversi, con interazioni intra-intermolari specifiche per diversi tipi di diversi tipi.
Funzioni
Gli enzimi ossidorti catalizzano le reazioni di riduzione dell'ossido virtualmente in tutte le cellule di tutti gli esseri viventi sulla biosfera. Queste reazioni sono generalmente reversibili, in cui viene alterato lo stato di ossidazione di uno o più atomi all'interno della stessa molecola.
Di solito gli ossidarestoni hanno bisogno di due substrati, uno che funge da donatore di idrogeno o elettroni (che si ossida) e un altro che funge da accettore di idrogeno o elettroni (che è ridotto).
Questi enzimi sono estremamente importanti per molti processi biologici in diversi tipi di cellule e organismi.
Funzionano, ad esempio, nella sintesi della melanina (un pigmento che si forma nelle cellule della pelle degli esseri umani), nella formazione e nella degradazione della lignina (composto strutturale delle cellule vegetali), nella piegatura delle proteine, ecc.
Può servirti: specie introdotte nelle Isole GalapagosSono usati industrialmente per modificare la consistenza di alcuni alimenti e l'esempio di questi sono le perossidasi, il glucosio ossidasi e altri.
Inoltre, gli enzimi più importanti di questo gruppo sono quelli che partecipano come trasportatori elettronici nelle catene del trasportatore della membrana mitocondriale, dei cloroplasti e della membrana plasmatica interna dei batteri, dove sono proteine transmembranali.
Esempi di ossidorti
Ci sono centinaia di esempi di enzimi ossidorti nella natura e nell'industria. Questi enzimi, come detto, hanno funzioni di massima importanza per il funzionamento cellulare e, quindi, per la vita di per sé.
L'ossididuttasi non include solo enzimi perossidasi, lacca, glucosio ossidasi o alcol deidrogeno; Combinano anche complessi importanti come l'enzima 3-fosfato deidrogenasi di gliceraldeide o il complimenus deidrogenasi, ecc., essenziale dal punto di vista del catabolismo del glucosio.
Include anche tutti gli enzimi del complesso di trasporto elettronico nella membrana mitocondriale interna o nella membrana interna dei batteri, simili ad alcuni degli enzimi trovati nei cloroplasti degli organismi vegetali.
Perossidasi
Le perossidasi sono enzimi molto diversi e usano il perossido di idrogeno come accettore di elettroni per catalizzare l'ossidazione di una varietà di substrati, tra cui fenoli, ammine o tiolle, tra gli altri. Nelle sue reazioni riducono il perossido di idrogeno fino a non produrre acqua.
Sono molto importanti dal punto di vista industriale, essendo la perossidasi del ravanello piccante il più importante e il più studiato di tutti.
Biologicamente parlando, le perossidasi sono importanti per l'eliminazione dei composti di ossigeno del reagente che possono causare danni significativi alle cellule.
Riferimenti
- Britannica Enciclopedia. (2019). Estratto il 26 dicembre 2019 da WWW.Britannica.com
- Ercili-Cura, d., Hupperz, t., & Kelly, a. L. (2015). Modifica enzimatica della consistenza del prodotto lattiero -caseario. Nella modifica della consistenza alimentare (PP. 71-97). Woodhead Publishing.
- Mathews, c. K., Van Holde, K. E., & Ahern, K. G. (2000). Biochimica. AGGIUNGERE. Wesley Longman, San Francisco.
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Comitato nomenclatura dell'Unione internazionale di biochimica e biologia molecolare (NC-IBMB). (2019). Estratto da www.Qmul.AC.UK/SBCS/IUBMB/Enzyme/Index.Html
- Patel, m. S., Nemeria, n. S., Furey, w., & Jordan, F. (2014). I complessi piruvato deidrogenasi: funzione e regolazione struttura-base. Journal of Biological Chemistry, 289 (24), 16615-16623.

