Proprietà dell'ossigeno, struttura, rischi, usi

- 897
- 151
- Dante Morelli
Lui ossigeno È un elemento chimico che è rappresentato dal simbolo o. È un gas molto reattivo, che dirige il gruppo 16: i calcolati. Questo nome è perché lo zolfo e l'ossigeno sono presenti in quasi tutti i minerali.
La sua elevata elettronegatività spiega la sua grande avidità da parte degli elettroni, che porta a combinarsi con un numero elevato di elementi; Ecco come sorge una vasta gamma di ossidi minerali che arricchiscono la crosta terrestre. Pertanto, il restante ossigeno compone e rende l'atmosfera traspirante.
 L'ossigeno è generalmente sinonimo di aria e acqua, ma si trova anche in rocce e minerali. Fonte: pxhere.
L'ossigeno è generalmente sinonimo di aria e acqua, ma si trova anche in rocce e minerali. Fonte: pxhere. L'ossigeno è il terzo elemento in abbondanza nell'universo, dietro l'idrogeno ed elio, ed è anche il principale componente di massa della corteccia terrestre. Ha una percentuale di volume del 20,8% dell'atmosfera terrestre e rappresenta l'89% della massa d'acqua.
Di solito ha due forme altropiche: ossigeno diatomico (o2), che è il modo più frequente in natura e ozono (o3), trovato nella stratosfera. Tuttavia, ce ne sono altri due (o4 IO8) che esistono nelle sue fasi liquide o solide e sotto enormi pressioni.
L'ossigeno viene costantemente prodotto attraverso il processo di fotosintesi, eseguito da fitoplancton e piante terrestri. Una volta prodotto, viene rilasciato in modo che gli esseri viventi possano usarlo, mentre una piccola parte di esso si dissolve nei mari, sostenendo la vita acquatica.
È quindi un elemento essenziale per gli esseri viventi; Non solo perché è presente nella maggior parte dei composti e delle molecole che li formano, ma intervengono anche in tutti i loro processi metabolici.
Sebbene controverso il suo isolamento sia attribuito a Carl Scheele e Joseph Priestley nel 1774, ci sono indicazioni che l'ossigeno fosse effettivamente isolato per la prima volta nel 1608, da Michael Sendivogius.
Questo gas viene utilizzato nella pratica medica per migliorare le condizioni di vita dei pazienti con difficoltà respiratorie. Allo stesso modo, l'ossigeno viene utilizzato per consentire alle persone di svolgere le loro funzioni in ambienti in cui è ridotto o nessun accesso all'ossigeno atmosferico.
L'ossigeno prodotto commercialmente viene utilizzato principalmente nell'industria metallurgica per la conversione del ferro in acciaio.
[TOC]
Storia
Spirito nitroariale
Nel 1500, Leonardo da Vinci, basato sugli esperimenti di Philo de Byzantium tenuti nel II secolo a. C., Ha concluso che una parte dell'aria veniva consumata durante la combustione e la respirazione.
Nel 1608, il drebble di Cornelius mostrò che la sala riscaldante (nitrato d'argento, KNO3) Si è verificato un gas. Questo gas, come sarebbe noto in seguito, era ossigeno; Ma Drebble non è riuscito a identificarlo come un nuovo elemento.
Quindi, nel 1668, John Majow sottolineò che una parte dell'aria chiamò "Spiritus Nitroaerus" era responsabile del fuoco e che fu anche consumato durante la respirazione e la combustione delle sostanze. Majow ha osservato che le sostanze non hanno organizzato in assenza dello spirito nitroariale.
Majoow eseguì la combustione antimonio e osservò un aumento del peso dell'antimonio durante la sua combustione. Quindi, Majow ha concluso che l'antimonio combinato con lo spirito nitroariale.
Scoperta
Sebbene non abbia ricevuto il riconoscimento dalla comunità scientifica, nella vita o dopo la sua morte, Michael Sandivogius (1604) è probabilmente il vero scopritore di ossigeno.
Sandivogius era un alchimista, filosofo e medico svedese che ha prodotto la decomposizione termica del nitrato di potassio. I suoi esperimenti lo hanno portato al rilascio di ossigeno, che ha chiamato "Cibus vitae": cibo della vita.
Tra il 1771 e il 1772, il chimico svedese Carl W Scheele riscaldò diversi composti: nitrato di potassio, ossido di manganese e ossido di mercurio. Scheele ha osservato che un gas che ha aumentato la combustione è stato rilasciato da loro e a cui ha chiamato "Air Air".
Esperimenti sacerdotali di Joseph
Nel 1774, il chimico inglese Joseph sacerdotale riscaldò l'ossido di mercurio usando una lente di aumento di dodici pollici che concentrava la luce solare. L'ossido di mercurio ha rilasciato un gas che ha fatto bruciare la candela molto più velocemente del normale.
Inoltre, il sacerdote ha testato l'effetto biologico del gas. Per fare questo, ha messo in un container chiuso un topo che si aspettava di sopravvivere a quindici minuti; Tuttavia, in presenza di gas è sopravvissuto a un'ora, più di quanto stimato.
Priestly pubblicò i suoi risultati nel 1774; Mentre Scheele lo fece nel 1775. Per questo motivo, la scoperta dell'ossigeno al sacerdote è di solito attribuita.
Ossigeno nell'aria
Antoine Lavoisier, un chimico francese (1777), ha scoperto che l'aria contiene ossigeno del 20% e che quando una sostanza brucia, in realtà si combina con l'ossigeno.
Lavoisier ha concluso che l'apparente aumento di peso che le sostanze sperimentate durante la combustione erano dovute alla perdita di peso che si verifica nell'aria; Poiché l'ossigeno combinato con queste sostanze e, quindi, le masse dei reagenti sono state conservate.
Ciò ha permesso a Lavoisier di stabilire la legge di conservazione della materia. Lavoisier ha suggerito il nome di ossigeno che proveniva dall'acido "acido" e "geni" della radice. Quindi ossigeno significa "acido ex".
Questo nome è sbagliato, poiché non tutti gli acidi contengono ossigeno; Ad esempio, alogenidi idrogeno (HF, HCL, HBR e HI).
Dalton (1810) assegnato all'acqua la formula chimica Ho e quindi il peso atomico dell'ossigeno era 8. Un gruppo di sostanze chimiche, tra cui: Davy (1812) e Berzelius (1814) ha corretto l'approccio di Dalton e ha concluso che la formula corretta dell'acqua è H2O e il peso atomico dell'ossigeno è 16.
Può servirti: acqua disciplinataProprietà fisiche e chimiche
Aspetto
Incolore, toilette e gas insipido; Mentre l'ozono ha un odore di acro. L'ossigeno favorisce la combustione, ma di per sé non è un carburante.
 Ossigeno liquido. Fonte: Staff Sgt. Nika Glover, u.S. Air Force [dominio pubblico]
Ossigeno liquido. Fonte: Staff Sgt. Nika Glover, u.S. Air Force [dominio pubblico] Nella sua forma liquida (immagine superiore) è blu pallido e anche i suoi cristalli sono bluastri; Ma possono acquisire toni rosa, arancione e persino rossastri (come verrà spiegato nella sezione della loro struttura).
Peso atomico
15.999 u.
Numero atomico (Z)
8.
Punto di fusione
-218,79 ºC.
Punto di ebollizione
-182.962 ºC.
Densità
In condizioni normali: 1.429 g/l. L'ossigeno è un gas più denso dell'aria. Inoltre, è un cattivo conduttore di calore ed elettricità. E nel suo punto di ebollizione (liquido), la densità è di 1,141 g/ml.
Triplo punto
54.361 K e 0,1463 kPa (14,44 atm).
Punto critico
154.581 K e 5.043 MPA (49770.54 ATM).
Calore di fusione
0,444 kJ/mol.
Calore di vaporizzazione
6,82 kJ/mol.
Capacità calorica molare
29.378 J/(mol · K).
Pressione del vapore
A una temperatura di 90 K ha una pressione del vapore di 986,92 atm.
Stati di ossidazione
-2, -1, +1, +2. Lo stato di ossidazione più importante è -2 (o2-).
Elettronegatività
3.44 sulla scala Pauling
Energia ionizzata
Primo: 1.313,9 kJ/mol.
Secondo: 3.388,3 kJ/mol.
Terzo: 5.300,5 kJ/mol.
Ordine magnetico
Paramagnetico.
Solubilità dell'acqua
La solubilità dell'ossigeno in acqua diminuisce all'aumentare della temperatura. Ad esempio: 14,6 ml di ossigeno/L di acqua vengono sciolti a 0 ºC e 7,6 ml di ossigeno/L di acqua a 20 ºC. La solubilità dell'ossigeno nell'acqua potabile è maggiore che nell'acqua di mare.
Nella condizione di temperatura 25 ºC e ad una pressione 101,3 kPa, l'acqua potabile può contenere 6,04 ml di ossigeno/L di acqua; Mentre acqua di mare solo 4,95 ml di ossigeno/L di acqua.
Reattività
L'ossigeno è un gas altamente reattivo che reagisce direttamente con quasi tutti gli elementi a temperatura ambiente e alte temperature; Ad eccezione dei metalli con potenziali di riduzione più elevati rispetto al rame.
Puoi anche reagire con i composti, ossidando gli elementi presenti in essi. Questo è ciò che accade quando reagisce con il glucosio, ad esempio, per produrre acqua e anidride carbonica; o quando il legno o un idrocarburo bruciano.
L'ossigeno può accettare elettroni per trasferimento completo o parziale, quindi è considerato un agente ossidante.
Il numero di ossidazione più comune o lo stato di ossidazione è -2. Con questo numero di ossidazione si trova nell'acqua (h2O), biossido di zolfo (SO2) e anidride carbonica (CO2).
Inoltre, in composti organici come aldeidi, alcoli, acidi carbossilici; acidi comuni come H2SW4, H2Co3, Hno3; e nei suoi sali derivati: Na2SW4, N / a2Co3 Ok no3. In tutti loro, si potrebbe assumere l'esistenza dell'O2- (che non è vero per i composti organici).
Ossidi
L'ossigeno è presente come o2- Nelle strutture cristalline di ossidi metallici.
D'altra parte, in superossidi metallici, come il superossido di potassio (KO2), l'ossigeno è come ioni o2-. Mentre si trova in perossidi metallici, per dire perossido di bario (BAO2), l'ossigeno è presentato come lo ione o22- (BA2+O22-).
Isotopi
L'ossigeno ha tre isotopi stabili: 16Oppure, con abbondanza del 99,76%; Lui 17Oppure, con 0,04%; e il 18Oppure, con lo 0,20%. Nota che lui 16O è di gran lunga l'isotopo più stabile e abbondante.
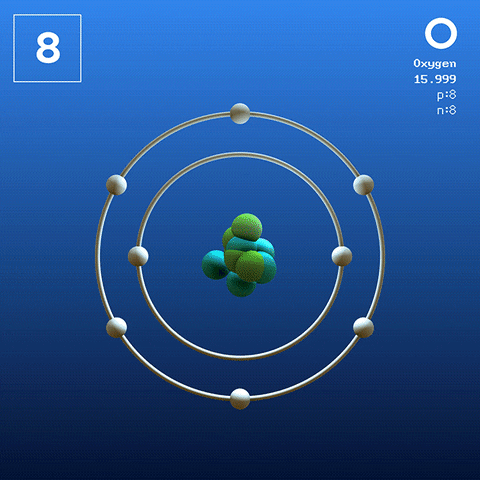
Struttura elettronica e configurazione
Molecola di ossigeno e interazioni
 Molecola di ossigeno diatomico. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Molecola di ossigeno diatomico. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] L'ossigeno nel suo stato basale è un atomo la cui configurazione elettronica è:
[Lui] 2s2 2 p4
Secondo la Valencia Link Theory (TEV), due atomi di ossigeno sono collegati in modo covalente in modo che entrambi completino separatamente il loro ottetto di Valencia; Oltre a poter accoppiarsi i loro due elettroni solitari degli orbitali 2p.
In questo modo, appare la molecola diatomica dell'ossigeno, o2 (Immagine superiore), che ha un doppio legame (O = O). La sua stabilità di energia è tale che l'ossigeno non si trova mai come singoli atomi nella fase gassosa ma come molecole.
Perché il o2 È omonucleare, lineare e simmetrico, manca di un momento di dipolo permanente; Pertanto, le sue interazioni intermolecolari dipendono dalla sua massa molecolare e dalle forze di dispersione di Londra. Queste forze sono relativamente deboli per l'ossigeno, il che spiega perché è un gas in condizioni terrestri.
Tuttavia, quando la temperatura diminuisce o aumenta la pressione, le molecole o2 Sono costretti a coeso; Al punto che le loro interazioni diventano significative e consentono la formazione di ossigeno liquido o solido. Per cercare di capirli molecolarmente, è necessario non perdere di vista la O2 come unità strutturale.
Ozono
L'ossigeno può adottare altre strutture molecolari considerevolmente stabili; Cioè, si trova in natura (o all'interno del laboratorio) in varie forme altropi. L'ozono (immagine inferiore), o3, Ad esempio, è il secondo alotropo dell'ossigeno più noto.
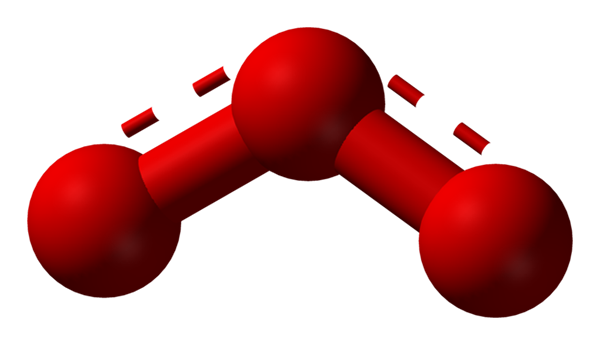 Struttura dell'ibrido di risonanza rappresentato da un modello di sfere e barre per la molecola di ozono. Fonte: Ben Mills via Wikipedia.
Struttura dell'ibrido di risonanza rappresentato da un modello di sfere e barre per la molecola di ozono. Fonte: Ben Mills via Wikipedia. Ancora una volta, il TEV tiene, spiega e dimostra che in o3 Ci devono essere strutture di risonanza che stabilizzano il carico formale positivo dell'ossigeno centrale (linee punteggiate in rosso); Mentre l'ossigeno dalla fine del boomerang viene distribuito un carico negativo, causando il carico totale per l'ozono.
Può servirti: regole di solubilità: aspetti e regole generaliIn questo modo, i collegamenti non sono semplici, ma non il doppio. Esempi di ibridi di risonanza sono molto comuni in altrettante molecole o ioni inorganici.
Il o2 IO3, Di conseguenza che le loro strutture molecolari sono diverse, lo stesso vale per le loro proprietà fisiche e chimiche, fasi liquide o cristalline (anche se entrambi consumano atomi di ossigeno). Teorizzano quella sintesi a grandi scale di ozono ciclico, la cui struttura ricorda quella di un triangolo rossastro e ossigenato.
Finora arrivano gli "alotropi normali" di ossigeno. Tuttavia, ce ne sono altri due da considerare: O4 IO8, trovato o proposto in ossigeno liquido e solido, rispettivamente.
Ossigeno liquido
L'ossigeno gassoso è incolore, ma quando la temperatura scende a -183 ºC, si condensa in un liquido blu pallido (celeste simile). Interazioni tra molecole o2 È ora che anche i loro elettroni possono assorbire i fotoni nella regione rossa dello spettro visibile per riflettere il suo caratteristico colore blu.
Tuttavia, è stato teorizzato che in questo liquido ci sono più delle molecole semplici o2, ma anche una molecola o4 (Immagine inferiore). Sembra che l'ozono avesse "bloccato" un altro atomo di ossigeno che in qualche modo intercede dal carico formale appena descritto.
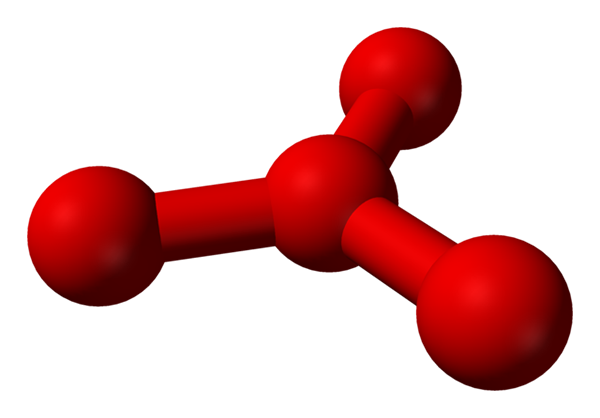 Modello Struttura proposta con sfere e barre per la molecola di tetraoxygen. Fonte: Benjah-BMM27 [dominio pubblico]
Modello Struttura proposta con sfere e barre per la molecola di tetraoxygen. Fonte: Benjah-BMM27 [dominio pubblico] Il problema è che secondo le simulazioni di computer e molecolari, detta struttura per O4 Non è precisamente stabile; Tuttavia, prevedono che esistono come unità (o2)2, Cioè, due molecole di O2 Si avvicinano così tanto che formano una sorta di cornice irregolare (atomi o non sono allineati tra loro).
Ossigeno solido
Una volta che la temperatura scende a -218,79 ºC, l'ossigeno si cristallizza in una semplice struttura cubica (fase γ). Man mano che la temperatura scende ancora di più, il vetro cubico soffre di transizioni alle fasi β (romboédica e a -229,35 ºC) e α (monoclinica e a -249,35 ºC).
Tutte queste fasi cristalline di ossigeno solido si verificano a pressione ambientale (1 atm). Quando la pressione aumenta a 9 GPa (~ 9000 atm), appare la fase Δ, i cui cristalli sono arancioni. Se la pressione continua ad aumentare a 10 GPa, appare l'ossigeno solido rosso o fase ε (di nuovo monoclinico).
La fase ε è speciale perché la pressione è così grande che molecole o2 Non solo sono ospitati come unità o4, ma anche o8:
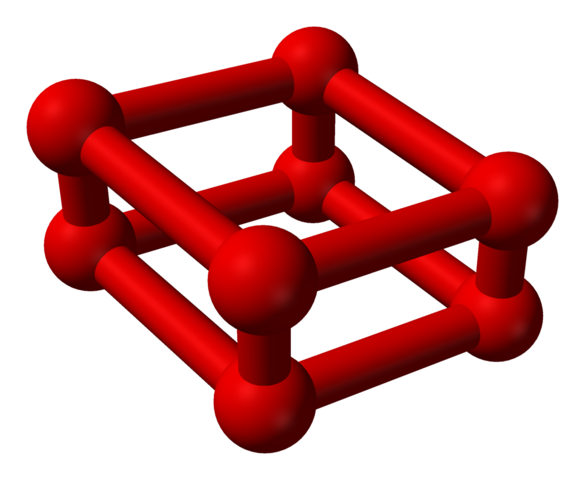 Struttura del modello con sfere e barre per molecola di ottaoxigeno. Fonte: Benjah-BMM27 [dominio pubblico]
Struttura del modello con sfere e barre per molecola di ottaoxigeno. Fonte: Benjah-BMM27 [dominio pubblico] Nota che questo o8 È costituito da due unità o4 dove il quadro irregolare ha già spiegato. È anche valido considerarlo come quattro o2 strettamente allineato e in posizioni verticali. Tuttavia, la sua stabilità è tale sotto questa pressione che il OR4 IO8 Sono due ulteriori alotropi per l'ossigeno.
E infine abbiamo la fase ζ, metallica (a pressioni superiori a 96 GPa), in cui la pressione rende gli elettroni dispersi nel vetro; come con i metalli.
Dov'è e produzione
Minerali
L'ossigeno è in massa il terzo elemento dell'universo, dietro l'idrogeno ed elio. Costituisce l'elemento più abbondante della crosta terrestre, che rappresenta circa il 50% della sua massa. È principalmente combinato con silicio, sotto forma di ossido di silicio (SIO2).
L'ossigeno fa parte di innumerevoli minerali. Allo stesso modo, si trova come parte di numerosi composti come carbonati, fosfati, solfati, nitrati, ecc.
Aria
L'ossigeno costituisce in volume il 20,8% dell'aria atmosferica. Nella troposfera è principalmente come una molecola di ossigeno diatomico. Mentre nella stratosfera, uno strato gassoso tra 15 e 50 km dalla superficie terrestre, è come l'ozono.
L'ozono è prodotto da una scossa elettrica sulla molecola di O2. Questo alotropo di ossigeno assorbe la luce ultravioletta delle radiazioni solari, bloccando la sua azione dannosa sull'uomo, che in casi estremi è associato alla comparsa di melanomi.
Acqua fresca e salata
L'ossigeno è un componente principale dell'acqua di mare e dell'acqua dolce da laghi, fiumi e acque sotterranee. L'ossigeno fa parte della formula chimica dell'acqua, massaggiando l'89%.
D'altra parte, sebbene la solubilità dell'ossigeno nell'acqua sia relativamente bassa, la quantità di ossigeno sciolta in questo è essenziale per la vita acquatica, che comprende numerose specie di animali e alghe.
Esseri viventi
L'essere umano è formato, circa il 60% dell'acqua e allo stesso tempo, ricco di ossigeno. Ma inoltre, l'ossigeno fa parte di numerosi composti, come fosfati, carbonati, acidi carbossilici, chetoni, ecc., che sono essenziali per la vita.
L'ossigeno è presente anche in polisaccaridi, lipidi, proteine e acidi nucleici; Cioè, le macromolecole biologiche così chiamate.
Fa anche parte dello spreco dannoso dell'attività dell'uomo, ad esempio: anidride carbonica e biossido, nonché anidride zolfo.
Produzione biologica
 Le piante sono responsabili dell'arricchimento dell'aria di ossigeno in cambio di anidride carbonica che espira. Fonte: Pexels.
Le piante sono responsabili dell'arricchimento dell'aria di ossigeno in cambio di anidride carbonica che espira. Fonte: Pexels. L'ossigeno si verifica durante la fotosintesi, un processo attraverso il quale il fitoplancton marino e le piante terrestri usano energia luminosa per reagire l'anidride carbonica con acqua, causando glucosio e rilasciando ossigeno.
Si stima che oltre il 55% dell'ossigeno prodotto dalla fotosintesi sia dovuto all'azione del fitoplancton marino. Pertanto, costituisce la principale fonte di generazione di ossigeno sulla terra ed è responsabile del mantenimento della vita in essa.
Produzione industriale
Liquefazione dell'aria
Il principale metodo di produzione industriale di ossigeno viene creato nel 1895, indipendentemente da Karl Paul Gottfried von Linde e William Hamson. Questo metodo sta attualmente utilizzando alcune modifiche.
Può servirti: butanone: struttura, proprietà e usiIl processo inizia con la compressione dell'aria per condensare il vapore acqueo e quindi eliminarlo. Quindi, l'aria viene setacciata se condotta da una miscela di zeolite e gel di silice, per l'eliminazione di anidride carbonica, idrocarburi pesanti e il resto dell'acqua.
Successivamente, i componenti dell'aria liquida sono separati attraverso una distillazione frazionaria, raggiungendo la separazione dei gas presenti nei suoi diversi punti di ebollizione. Con questo metodo l'ossigeno si ottiene con la purezza del 99%.
Elettrolisi dell'acqua
L'ossigeno è prodotto da elettrolisi dell'acqua altamente purificata e con conducibilità elettrica che non supera 1 µs/cm. L'acqua è separata dall'elettrolisi nei suoi componenti. L'idrogeno come catione si sposta sul catodo (-); Mentre l'ossigeno si sposta verso l'anodo (+).
Gli elettrodi hanno una struttura speciale per raccogliere i gas e successivamente produrre la loro liquefazione.
Decomposizione termica
La decomposizione termica di composti come ossido di mercurio e ospite (nitrato di potassio), rilascia ossigeno, che può essere raccolta per l'uso. I perossidi sono usati anche per questo scopo.
Carta biologica
L'ossigeno è prodotto dal fitoplancton e piante terrestri attraverso la fotosintesi. Attraversa la parete polmonare e nel sangue viene catturata dall'emoglobina, che la trasporta in organi diversi e quindi utilizzato nel metabolismo cellulare.
In questo processo l'ossigeno viene utilizzato durante il metabolismo di carboidrati, acidi grassi e aminoacidi, per produrre infine anidride carbonica ed energia.
La respirazione può schematizzare come segue:
C6H12O6 + O2 => Co2 + H2O +energia
Il glucosio viene metabolizzato in una serie di processi chimici sequenziali, che include glicolisi, ciclo di Krebs, catena di trasporto elettronico e fosforilazione ossidativa. Questa serie di eventi produce energia che si accumula come ATP (Adenosín Triposphate).
L'ATP viene utilizzato in vari processi nelle celle che include il trasporto di ioni e altre sostanze attraverso la membrana plasmatica; l'assorbimento intestinale di sostanze; la contrazione di diverse cellule muscolari; Il metabolismo di diverse molecole, ecc.
I leucociti polimorfonucleari e macrofagi sono cellule fagocitiche in grado di usare ossigeno per produrre ioni superossido, perossido di idrogeno e ossigeno singolo, che vengono utilizzati per distruggere i microrganismi.
Rischi
Respirare l'ossigeno ad alte pressioni può causare nausea, vertigini, spasmi muscolari, perdita della vista, convulsioni e perdita di coscienza. Inoltre, la respirazione di ossigeno puro per un lungo periodo di tempo provoca irritazione polmonare, manifestata per tosse e un accorciamento della respirazione.
Può anche essere la causa della formazione di un edema polmonare: una condizione molto grave che limita la funzione respiratoria.
Un'atmosfera con alta concentrazione di ossigeno può essere pericolosa, poiché facilita lo sviluppo di incendi ed esplosioni.
Applicazioni
Medici
L'ossigeno viene somministrato a pazienti che hanno insufficienza respiratoria; Questo è il caso dei pazienti affetti da polmonite, edema polmonare o enfisema. Non potevano respirare ossigeno ambientale perché sarebbero gravemente colpiti.
Anche i pazienti con insufficienza cardiaca in ciò che viene presentato l'accumulo di liquido negli alveoli necessitano di ossigeno; Come i pazienti che hanno subito un grave incidente vascolare (ictus).
Necessità professionale
I pompieri che stanno combattendo un incendio in un ambiente con ventilazione inappropriata, richiedono l'uso di maschere e bottiglia di ossigeno che consentono loro di svolgere le loro funzioni, senza mettere la propria vita in maggiori rischi.
I sottomarini sono dotati di attrezzature di produzione di ossigeno che consentono ai marinai di rimanere in un ambiente chiuso senza accesso all'aria atmosferica.
I subacquei svolgono il loro lavoro immerso nell'acqua e, quindi, isolati dall'aria atmosferica. Respirano per ossigeno pompato da tubi collegati alla loro scansione o all'uso di bombardieri attaccati al corpo del sottomarino.
Gli astronauti svolgono le loro attività in ambienti dotati di generatori di ossigeno che consentono la sopravvivenza durante le gite dello spazio e in una stazione spaziale.
Industriale
Più del 50% dell'ossigeno prodotto industrialmente viene consumato nella trasformazione del ferro in acciaio. La ghisa viene iniettata con un getto di ossigeno per eliminare lo zolfo e il carbonio presenti; reagire a produrre così gas2 e co2, rispettivamente.
L'acetilene viene utilizzato in combinazione con ossigeno per tagliare le piastre metalliche e anche per produrre la sua saldatura. L'ossigeno viene anche utilizzato nella produzione di vetro, aumentando la combustione nella sua cottura per migliorare la sua trasparenza.
Spettrofotometria di assorbimento atomico
La combinazione di acetilene e ossigeno viene utilizzata per bruciare campioni di origini diverse in uno spettrofotometro di assorbimento atomico.
Durante la procedura, un raggio di luce da una lampada è influenzato dalla fiamma, che è specifica dell'elemento che si desidera quantificare. La fiamma assorbe la luce della lampada, consentendo la quantificazione dell'elemento.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Ossigeno. Recuperato da: in.Wikipedia.org
- Richard Van Noordden. (13 settembre 2006). Solo una bella fase? Ossigeno rosso solido: inutile ma delizioso. Recuperato da: natura.com
- Azonano. (4 dicembre 2006). Strapture cristalline della fase elettronica di ossigeno solido determinato lungo le scoperte di un cluster di ossigeno O8. Recuperato da: Azonano.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Molecola di ossigeno. Database PubChem. CID = 977. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Dottore. Doug Stewart. (2019). Fatti per elementi di ossigeno. Chemicool. Recuperato da: Chemicool.com
- Robert C. Brastato. (9 luglio 2019). Ossigeno: elemento chimico. Encyclopædia Britannica. Recuperato da: Britannica.com
- Bambini wiki. (2019). Famiglia di ossigeno: proprietà di Via Elements. Recuperato da: semplicemente.Scienza
- Advameg, inc. (2019). Ossigeno. Recuperato da: madew.com
- Lentech b.V. (2019). Tabella del periodo: ossigeno. Recuperato da: lentech.com
- Dipartimento della salute e senior del New Jersey. (2007). Ossigeno: scheda informativa per sostanze pericolose. [PDF]. Recuperato da: NJ.Gov
- Yamel Mattarollo. (26 agosto 2015). Applicazioni industriali industriali di ossigeno. Recuperato da: Altecdust.com
- « Storia, proprietà, struttura, rischi, usi al neon
- Caratteristiche dell'istidina, struttura, funzioni, cibo »

