Orbitali degenerati

- 1833
- 171
- Silvano Montanari
 Schema energetico con gli orbitali occupati da elettroni mancanti. Fonte: Gabriel Bolívar
Schema energetico con gli orbitali occupati da elettroni mancanti. Fonte: Gabriel Bolívar IL Orbitali degenerati Sono quelli che si trovano allo stesso livello di energia. Secondo questa definizione, devono avere lo stesso numero quantico principale N. Pertanto, gli orbitali 2S e 2P sono degenerati, poiché appartengono al livello di energia 2, sebbene si sappia che le loro funzioni di onde angolari e radiali sono diverse.
Come i valori di N, Gli elettroni iniziano ad occupare altri sotto -livelli di energia, come D e F orbitali.
Ognuno di questi orbitali ha le proprie caratteristiche, che a prima vista si osserva nelle loro forme angolari; Queste sono le figure sferiche, di manubri (p), delle foglie di trifoglio (d) e globulare (f).
Tra questi c'è una differenza energetica, anche appartenente allo stesso livello N.
Ad esempio, uno schema energetico con gli orbitali occupati da elettroni mancanti (un caso anormale) è mostrato nell'immagine superiore (un caso anormale).
Si può vedere che di tutto il più stabile (la minima energia) è l'orbitale NS (1s, 2s, ...), mentre l'NF è il più instabile (quello con la massima energia).
Orbitali degenerati di un atomo isolato
Orbitali degenerati, con lo stesso valore di N, Sono nella stessa linea in uno schema energetico.
Per questo motivo, le tre strisce rosse che simboleggiano gli orbitali P si trovano nella stessa linea; Come allo stesso modo le strisce viola e gialle.
Lo schema di immagine viola la regola del lavandino: gli orbitali di maggiore energia sono riempiti con elettroni.
Può servirti: acidi e basi: differenze, caratteristiche, esempiQuando gli elettroni si accoppiano, l'orbitale perde energia ed esercita una maggiore repulsione elettrostatica sugli elettroni mancanti degli altri orbitali.
Tuttavia, tali effetti non sono considerati in molti diagrammi di energia. In tal caso, e obbedire alla regola del lavandino senza riempire completamente gli orbitali D, si vede che cessano di essere degenerati.
Come affermato sopra, ogni orbitale ha le sue caratteristiche. Un atomo isolato, con la sua configurazione elettronica, è disposto ai suoi elettroni nel numero preciso di orbitali che consentono loro di ospitarli.
Solo quelli in energia possono essere considerati degenerati.
Orbitali p
Le tre strisce rosse per gli orbitali dell'immagine dell'immagine indicano che entrambi PX, PE E pz Hanno la stessa energia.
C'è un elettrone scomparso in ognuno, descritto da quattro numeri quantistici (N, l, ml E SM), mentre i primi tre descrivono gli orbitali.
L'unica differenza tra loro è indicata dal momento magnetico ml, che disegna la traiettoria di pX Su un asse x, PE Sull'asse y e Pz Sull'asse z.
I tre sono uguali, ma differiscono solo nei loro orientamenti spaziali. Per questo motivo sono sempre attratti dall'energia, cioè degenerate.
Come lo stesso, un atomo di azoto inomotivo (con configurazione 1s22s22 p3) Devi mantenere i tuoi tre orbitali degenerati. Tuttavia, lo scenario energetico cambia bruscamente se è considerato un atomo di N all'interno di una molecola o composto chimica.
È così perché sebbene pX, PE E pz Sono uguali in energia, questo può variare in ciascuno di essi se hanno ambienti chimici diversi; Cioè, se sono collegati a atomi diversi.
Può servirti: isopreno: struttura, proprietà, applicazioniOrbitali d
Le cinque strisce viola indicano gli orbitali d. In un atomo isolato, anche se hanno elettroni accoppiati, sono considerati che questi cinque orbitali siano degenerati. Tuttavia, a differenza degli orbitali p, questa volta c'è una marcata differenza nelle loro forme angolari.
Pertanto, i loro elettroni viaggiano nelle direzioni nello spazio che variano da una d orbitale a un'altra.
Questo causa, secondo il Teoria del campo cristallino, che un disturbo minimo provoca a Energia che si svolge degli orbitali; Cioè, le cinque strisce viola si separano lasciando un divario energetico tra di loro:
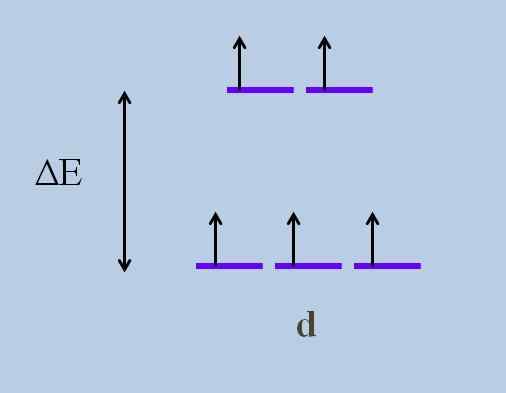 Schema di sviluppo dell'energia di orbitali. Fonte: Gabriel Bolívar
Schema di sviluppo dell'energia di orbitali. Fonte: Gabriel Bolívar Quali sono gli orbitali sopra e quali sono quelli sotto? Quelli sopra sono simboleggiati come EG, e quelli sotto T2 g.
Nota come inizialmente tutte le strisce viola sono state allineate e ora è stata formata una serie di due orbitali EG più energia rispetto all'altra serie di tre orbitali T2 g.
Questa teoria consente di spiegare le transizioni D-D, a cui vengono assegnati molti dei colori osservati nei composti dei metalli di transizione (CR, Mn, Faith, ecc.).
Questo disturbo elettronico è dovuto alle interazioni di coordinamento del centro metallico con altre molecole chiamate Ligandi.
Orbitali f
E con gli orbitali F, le sette strisce gialle, la situazione è ulteriormente complicata. I suoi indirizzi spaziali variano notevolmente tra loro e la visualizzazione dei loro collegamenti diventa troppo complessa.
In effetti, si ritiene che gli orbitali f siano di tale strato interno che non "partecipano in modo sensibile" alla formazione di collegamenti.
Può servirti: ossido perclorico (CL2O7)Quando l'atomo isolato con orbitali F è circondato da altri atomi, si verificano interazioni e si svolgono (perdita di degenerazione):
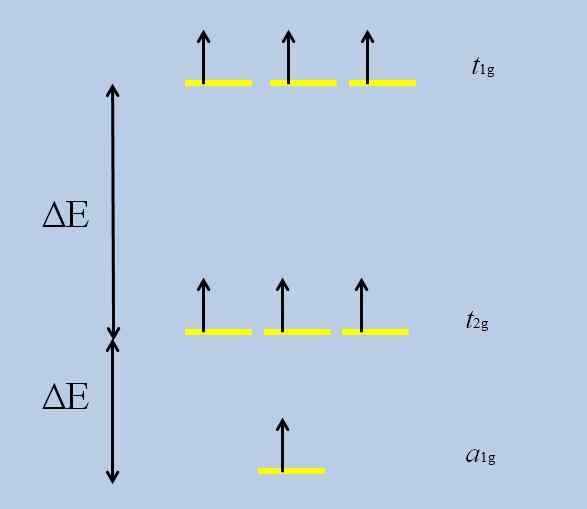 Schema di perdita di degenerazione. Fonte: Gabriel Bolívar
Schema di perdita di degenerazione. Fonte: Gabriel Bolívar Si noti che ora le strisce gialle formano tre set: T1g, T2 g E A1g, E non sono più degenerati.
Orbitali ibridi degenerati
È stato visto che gli orbitali possono svolgersi e perdere degenerazione. Tuttavia, sebbene ciò spieghi le transizioni elettroniche, non chiarisce come e perché ci sono diverse geometrie molecolari. Qui gli orbitali ibridi entrano.
La sua caratteristica principale è che sono degenerati. Quindi, derivano dalla miscela di personaggi orbitali s, p, d e f, per causare ibridi degenerati.
Ad esempio, tre orbitali P sono miscelati con una S per dare quattro orbitali SP3. Tutti gli orbitali SP3 Sono degenerati e quindi hanno la stessa energia.
Se inoltre due orbitali vengono miscelati con i quattro SP3, Saranno ottenuti sei orbitali3D2.
E come spiegano le geometrie molecolari? Poiché ce ne sono sei, con uguali energie, devono essere guidate simmetricamente nello spazio per generare uguali ambienti chimici (ad esempio, in un composto MF6).
Quando lo fanno, si forma un ottaedro di coordinamento, che è uguale a una geometria ottaedrica attorno a un centro (M).
Tuttavia, le geometrie di solito presentano distorsioni, il che significa che anche gli orbitali ibridi non sono completamente degenerati.
Pertanto, come conclusione, gli orbitali degenerati esistono solo in atomi isolati o ambienti altamente simmetrici.
Riferimenti
- Definizione di degerate. Recuperato da: Chemicool.com
- Atomi e orbitali atomici. Recuperato da Spark Notes.com
- Whitten, Davis, Peck e Stanley. Chimica. (8.ª ed.). Apprendimento del Cengage.

