Notazione spettrale

- 2567
- 84
- Rosolino Santoro
 Tabella che indica i livelli e gli orbitali
Tabella che indica i livelli e gli orbitali Cos'è la notazione spettrale?
IL Notazione spettrale È la disposizione degli elettroni a livelli di energia attorno al nucleo di un atomo. Secondo il vecchio modello atomico di Bohr, gli elettroni occupano diversi livelli nelle orbite attorno al nucleo, del primo strato più vicino al nucleo, K, al settimo strato, Q, che è il più lontano dal nucleo.
In termini di un modello meccanico quantistico più raffinato, gli strati K-Q sono suddivisi in un insieme di orbitali, ognuno dei quali può essere occupato da non più di un paio di elettroni.
Comunemente, la configurazione elettronica viene utilizzata per descrivere gli orbitali di un atomo nel suo stato fondamentale, ma può anche essere usato per rappresentare un atomo che è stato ionizzato in un catione o anione, compensando la perdita o il guadagno degli elettroni nei rispettivi orbitali.
Molte delle proprietà fisiche e chimiche degli elementi possono essere correlate alle loro configurazioni elettroniche uniche. Gli elettroni di Valencia, gli elettroni nello strato più esterno, sono il fattore determinante per la chimica unica dell'elemento.
Quando gli elettroni dello strato più esterno di un atomo ricevono energia da qualche tipo, si spostano a maggiori strati energetici. Pertanto, un elettrone nello strato K verrà trasferito allo strato L essendo in uno stato di massima energia.
Quando l'elettrone ritorna al suo stato fondamentale, rilascia l'energia che ha assorbito emettendo uno spettro elettromagnetico (luce). Poiché ogni atomo ha una configurazione elettronica specifica, avrà anche uno spettro specifico che verrà chiamato spettro di assorbimento (o emissione).
Per questo motivo, il termine notazione spettrale viene utilizzato per fare riferimento alla configurazione elettronica.
Come determinare la notazione spettrale: numeri quantici
Un totale di quattro numeri quantici vengono utilizzati per descrivere completamente il movimento e le traiettorie di ciascun elettrone all'interno di un atomo.
La combinazione di tutti i numeri quantici di tutti gli elettroni in un atomo è descritta da una funzione d'onda che soddisfa l'equazione di Schrödinger. Ogni elettrone in un atomo ha un set unico di numeri quantistici.
Può servirti: frazione molare: come viene calcolato, esempi, eserciziSecondo il principio di esclusione di Pauli, due elettroni non possono condividere la stessa combinazione di quattro numeri quantici.
I numeri quantici sono importanti perché possono essere utilizzati per determinare la configurazione elettronica di un atomo e la probabile posizione degli elettroni atomi.
I numeri quantici vengono anche usati per determinare altre caratteristiche degli atomi, come l'energia di ionizzazione e il raggio atomico.
I numeri quantici designano conchiglie, subcap, orbitali ed elettroni specifici.
Ciò significa che descrivono completamente le caratteristiche di un elettrone in un atomo, cioè descrivono ogni singola soluzione all'equazione di Schrödinger o alla funzione d'onda, elettroni in un atomo.
Esistono un totale di quattro numeri quantici: il numero quantico principale (N), il numero quantico dell'angolare orbitale (L), il numero quantico magnetico (ML) e il numero quantico della rotazione dell'elettrone (MS).
Il numero quantico principale, NN, descrive l'energia di un elettrone e la distanza più probabile dell'elettrone centrale. In altre parole, si riferisce alle dimensioni dell'orbitale e al livello di energia in cui viene posizionato un elettrone.
Il numero di subcap, o LL, descrive la forma dell'orbitale. Può anche essere usato per determinare il numero di nodi angolari.
Il numero quantico magnetico, ML, descrive i livelli di energia in un subcap e più si riferisce alla rotazione sull'elettrone, che può essere su o giù.
Principio di Aufbau
Aufbau viene dalla parola tedesca Aufbauen, Cosa significa "costruzione". In sostanza, quando scriviamo configurazioni di elettroni stiamo costruendo orbitali elettronici mentre avanzaremo da un atomo a un altro.
Mentre scriviamo la configurazione elettronica di un atomo, riempiremo gli orbitali in ordine crescente di numero atomico.
Il principio di Aufbau proviene dal principio di esclusione di Pauli, che dice che non ci sono due fermioni (ad esempio, elettroni) in un atomo.
Può servirti: acido butirrico: formula, proprietà, rischi e usiPossono avere lo stesso insieme di numeri quantici, quindi devono "accumularsi" a livelli di energia più elevati. Come si accumulano gli elettroni è un argomento delle impostazioni di elettroni.
Gli atomi stabili hanno tanti elettroni quanti sono i protoni nel nucleo. Gli elettroni si radunano attorno al nucleo in orbitali quantistici seguendo quattro regole di base chiamate principi di Aufbau.
1. Non ci sono due elettroni nell'atomo che condividevano gli stessi quattro numeri quantici N, L, M e S.
2. Gli elettroni occuperanno prima gli orbitali del livello di energia più basso.
3. Gli elettroni riempiranno sempre gli orbitali con lo stesso numero di spin. Quando gli orbitali sono pieni, inizierà.
4. Gli elettroni riempiranno gli orbitali per la somma dei numeri quantici N e L. Gli orbitali con valori uguali (n + l) verranno riempiti prima con valori N più bassi.
La seconda e la quarta regola sono sostanzialmente le stesse. Un esempio di regola quattro sarebbe orbitali 2p e 3s.
Un orbitale 2p è n = 2 e l = 2 e un orbitale 3s è n = 3 e l = 1. (N + l) = 4 in entrambi i casi, ma l'orbitale 2p ha l'energia più bassa o il valore inferiore e verrà riempito prima dello strato 3s.
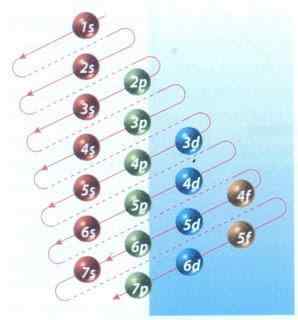 Figura 2: diagramma Moeller di riempimento di configurazione elettronica
Figura 2: diagramma Moeller di riempimento di configurazione elettronica Fortunatamente, puoi usare il diagramma Moeller mostrato nella Figura 2 per riempire gli elettroni. Il grafico viene letto eseguendo le diagonali da 1s.
La Figura 2 mostra che gli orbitali e le frecce atomici indicano la strada da seguire.
Ora che è noto che l'ordine degli orbitali è riempito, l'unica cosa che rimane è memorizzare le dimensioni di ciascun orbitale.
Gli orbitali hanno 1 possibile valore di ml Per contenere 2 elettroni
I p orbitali hanno 3 possibili valori di ml Per contenere 6 elettroni
Gli orbitali hanno 5 possibili valori di ml Per contenere 10 elettroni
Gli orbitali f hanno 7 possibili valoril Per contenere 14 elettroni
Questo è tutto ciò che è necessario per determinare la configurazione elettronica di un atomo stabile di un elemento.
Può servirti: dodecil sodio solfato (SDS): struttura, proprietà, usiAd esempio, prendi l'elemento di azoto. L'azoto ha sette protoni e, quindi, sette elettroni. Il primo orbitale da riempire è l'orbitale 1S. Una S orbitale ha due elettroni, quindi sono rimasti cinque elettroni.
Il prossimo orbitale è l'orbitale 2S e contiene i due successivi. I tre elettroni finali andranno all'orbitale 2p che può contenere fino a sei elettroni.
Regole di lavandino
La sezione Aufbau ha discusso di come gli elettroni riempiono prima gli orbitali di energia più bassi e poi si spostano verso gli orbitali di energia più alti solo dopo che gli orbitali di energia inferiori sono pieni.
Tuttavia, c'è un problema con questa regola. Certamente, gli orbitali 1S devono essere riempiti prima degli orbitali 2S, perché gli orbitali 1s hanno un valore inferiore di N e, quindi, un'energia inferiore.
E i tre diversi orbitali? In quale ordine dovrebbero essere riempiti? La risposta a questa domanda prevede la regola del lavandino.
La regola del lavandino stabilisce che:
- Ogni orbitale in sotto -livello è occupato individualmente prima che qualsiasi orbitale sia doppiamente occupato.
- Tutti gli elettroni negli orbitali occupati individualmente hanno lo stesso turno (per massimizzare la svolta totale).
Quando gli elettroni vengono assegnati agli orbitali, un elettrone cerca prima di riempire tutti gli orbitali di energia simile (chiamata anche orbitali degenerati) prima di abbinare un altro elettrone in un orbitale mezzo pieno.
Gli atomi negli stati della Terra tendono ad avere il maggior numero possibile di elettroni. Quando si visualizzano questo processo, considera come gli elettroni mostrano lo stesso comportamento degli stessi poli in un magnete se contattano.
Quando gli elettroni caricati negativamente riempiono gli orbitali, cercano prima di scappare il più possibile prima di dover abbinare.
Riferimenti
- Numeri quantici. Chimica recuperata.Librettexts.org.
- Configurazioni di elettroni e proprietà degli atomi (s.F.). Recuperato da Oneonta.Edu.
- Configurazione elettronica. Recuperato dalla Britannica.com.

