Nitrobenzene (C6H5NO2) Struttura, proprietà, usi, rischi

- 2984
- 87
- Enzo De Angelis
Lui nitrobenzene È un composto organico aromatico formato da un anello benzenico C6H5- E un gruppo Nitro -No2. La sua formula chimica è C6H5NO2. È un fluido oleoso colorato o giallo pallido, con un odore di mandorle amare o scarpe per scarpe.
Il nipobenzene è un composto molto utile nell'industria chimica perché consente di ottenere una serie di sostanze chimiche che hanno usi vari. Questo perché può essere soggetto a vari tipi di reazioni.
 Nitrobencene, c6H5-NO2. Autore: Marilú Stea.
Nitrobencene, c6H5-NO2. Autore: Marilú Stea. Tra le importanti reazioni chimiche ci sono la nitrazione (che consente di aggiungere più gruppi, non2 alla molecola) e la riduzione (l'opposto dell'ossidazione come i due atomi di ossigeno del gruppo nitro -NO vengono eliminati2 e sono sostituiti dagli idrogeni).
Con Nitrobencene puoi prepararti ad esempio anilina e para-acetaminofenolo. Quest'ultimo è il ben noto paracetamolo che è un antipiretico (farmaco febbre) e analgesico morbido (farmaco del dolore minore).
Il nipobenzene deve essere manipolato con cautela perché è irritante e tossico, può causare un tipo di anemia, tra i diversi sintomi, e si ritiene che possa causare il cancro. È anche dannoso per l'ambiente.
[TOC]
Struttura
Il nitrobenzene c6H5-NO2 È una molecola piatta formata da un anello benzenico C6H5- a cui è collegato un gruppo nitro -no2. La sua molecola è piatta perché esiste un'interazione elettronica tra il gruppo nitro -NO2 e l'anello di benzene.
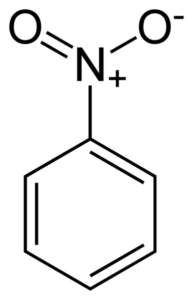 Struttura piatta della molecola di nitrobenzene. Gli elettroni dei collegamenti a doppio anello Bonyan tendono ad interagire con il gruppo Nitro -No2. Autore: Benjah-BMM27. Fonte: Wikimedia Commons.
Struttura piatta della molecola di nitrobenzene. Gli elettroni dei collegamenti a doppio anello Bonyan tendono ad interagire con il gruppo Nitro -No2. Autore: Benjah-BMM27. Fonte: Wikimedia Commons. Il gruppo Nitro -No2 tende ad attirare gli elettroni dell'anello benzenico C6H5-.
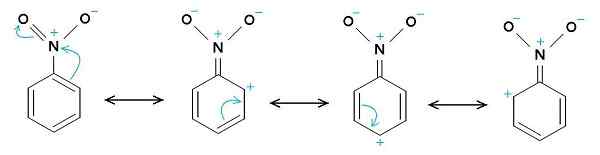 Strutture di risonanza di nitrobenzene. L'anello di benzene tende ad avere un carico positivo, mentre il gruppo Nitro -NO2 tende ad avere un carico negativo. Il caricatore originale era Samuele Madini alla Wikipedia italiana. [Dominio pubblico]. Fonte: Wikimedia Commons.
Strutture di risonanza di nitrobenzene. L'anello di benzene tende ad avere un carico positivo, mentre il gruppo Nitro -NO2 tende ad avere un carico negativo. Il caricatore originale era Samuele Madini alla Wikipedia italiana. [Dominio pubblico]. Fonte: Wikimedia Commons. Ecco perché la molecola ha un lato leggermente più negativo (dove sono l'ossigeno di -No2) e un lato leggermente più positivo (l'anello del benzene).
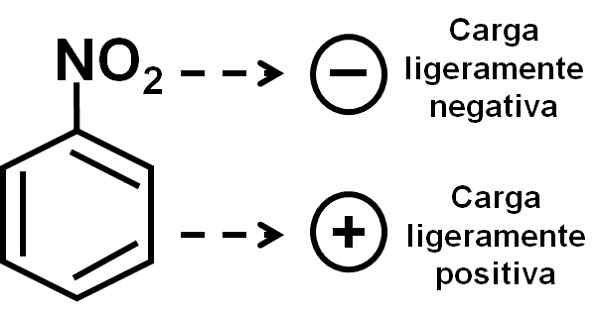 L'ossigeno del gruppo nitro ha un carico leggermente negativo rispetto all'anello benzenico. Autore: Marilú Stea.
L'ossigeno del gruppo nitro ha un carico leggermente negativo rispetto all'anello benzenico. Autore: Marilú Stea. Nomenclatura
- Nitrobenzene.
- Nitrobenza.
- Nitrobenzolo.
- Petrolio o essenza di mirbano o mirbana (termine in disuso).
Proprietà
Stato fisico
Liquido oleoso colorato a giallo pallido.
Peso molecolare
123,11 g/mol.
Punto di fusione
5,7 ºC.
Punto di ebollizione
211 ºC.
Può servirti: cloruro di cobalto (COCL2 (: struttura, nomenclatura, proprietàPunto d'infiammabilità
88 ºC (metodo di coppa chiusa).
Temperatura di autorezione
480 ° C.
Densità
1.2037 g/cm3 a 20 ºC.
Solubilità
Piccola acqua solubile: 0,19 g/100 g di acqua a 20 ° C. Completamente miscibile con alcol, benzene e diete.
Proprietà chimiche
Il nitrobence è stabile fino a circa 450 ° C di temperatura in cui inizia a decomporre la formazione (in assenza di ossigeno) no, no2, benzene, bifenil, anilina, dibenzofurano e naftalene.
Tra le reazioni importanti del nitrobencene vi sono la riduzione, la nitrazione, l'alogenazione e la solfonazione.
La nitrazione di nitrobenzene inizialmente produce meta-nitrobenzene e con un lungo tempo di reazione, si ottiene 1,3,5-nitobenzene.
Reacting bromo o cloro con nitrobenzene in presenza di un catalizzatore appropriato si ottiene 3-bromo-nitrobenzene (meta-bromonitrobencene) o 3-clor-nitrobenzene (meta-clororonitrobenzene).
Un esempio di riduzione è che quando si tratta di stagno (SN) in acido cloridrico (HCl) i meta-alogenonitobenzeni sono ottenuti dai meta-alogeniline.
La solfonazione di nitrobenzene viene eseguita con acido solforico fumo a 70-80 ° C e il prodotto è meta-nitrobenzeulfonico meta-nitrobenza. Questo può essere ridotto con ferro e HCL per dare l'acido metanilico.
Formazione dimmer
In una soluzione di benzene c6H6 Le molecole di nitrobence sono associate tra loro che formano diametro o molecole. In queste coppie una delle molecole è in una posizione invertita rispetto all'altra.
La formazione di diametri di nitrobenzene con molecole uno in una posizione invertita rispetto all'altra è probabilmente dovuta al fatto che ciascuno di essi ha un lato leggermente più positivo e un lato opposto con un carico leggermente più negativo.
Nel dimero il lato con un carico leggermente più positivo di una delle molecole si trova probabilmente vicino al carico leggermente negativo dell'altra molecola, perché i carichi opposti sono attratti, e quindi succede con gli altri due lati.
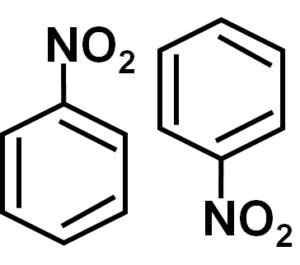 Numero di nitrobence, cioè due molecole che tendono ad stare insieme in alcuni solventi. Autore: Marilú Stea.
Numero di nitrobence, cioè due molecole che tendono ad stare insieme in alcuni solventi. Autore: Marilú Stea. Altre proprietà
Presenta un odore simile alle mandorle o al lucido per le scarpe. Abbassando la sua temperatura solidifica sotto forma di cristalli gialli verdastri.
Ottenimento
Ricevi il trattamento del benzene C6H6 Con una miscela di acido nitrico HNO3 e acido solforico H2SW4. Il processo è chiamato nitrazione e comporta la formazione dello ione di nitronio no2+ Grazie alla presenza di acido solforico H2SW4.
- Nitronio ion n2+:
Hno3 + 2 h2SW4 ⇔ h3O+ + 2 HSO4- + NO2+ (Nitronio ion)
- Lo ione Nitronio attacca il benzene:
Può servirti: errore sistematico: come calcolarlo, in chimica, in fisica, esempiC6H6 + NO2+ → C6H6NO2+
- Nitrobencene è formato:
C6H6NO2+ + HSO4- → C6H5NO2 + H2SW4
In sintesi:
C6H6 + Hno3 → C6H5NO2 + H2O
La reazione di nitrazione del benzene è molto esotermica, cioè molto calore, quindi è molto pericoloso.
Applicazioni
Nel ottenere anilina e paracetamolo
Il nitrobencene è usato principalmente per sintetizzare l'anilina C6H5NH2, che è un composto ampiamente usato per la preparazione di pesticidi, gengive, coloranti, esplosivi e farmaci.
Ottenere l'anilina si verifica riducendo il nitrobenzene in mezzo acido in presenza di ferro o stagno, che viene eseguito secondo le seguenti fasi:
Nitrobenzene → nitrosobenzene → fenilidrossilammina → anilina
C6H5NO2 → C6H5No → c6H5Nhoh → c6H5NH2
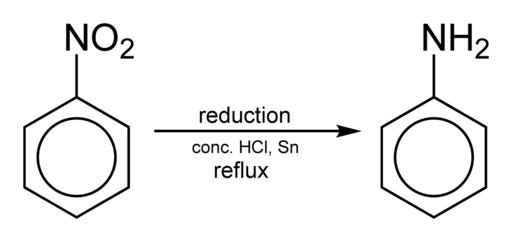 Riduzione del nitrobence per ottenere anilina. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Riduzione del nitrobence per ottenere anilina. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. A seconda delle condizioni, il processo può essere interrotto in uno dei passaggi intermedi, ad esempio nella fenilidrossilammina. A partire dalla fenilidrossilammina in un ambiente fortemente acido, il para-aminofenolo può essere preparato:
Fenilhdroxylammina → P-Aminofenolo
C6H5Nhoh → hoc6H4NH2
Quest'ultimo è trattato con anidride acetica per ottenere paracetamolo (paracetamolo) un analgesico antipiretico e morbido delicato, cioè un farmaco per trattare la febbre, il dolore e il dolore.
 A volte è possibile medicare con paracetamolo ai bambini con febbre. Il paracetamolo è un derivato di nitrobenzene. Autore: Augusto Ordonez. Fonte: Pixabay.
A volte è possibile medicare con paracetamolo ai bambini con febbre. Il paracetamolo è un derivato di nitrobenzene. Autore: Augusto Ordonez. Fonte: Pixabay.  Pillole di paracetamolo, un derivato di nitrobenzene. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe di Ottawa, Canadaderivative Work: Anrie [CC di (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons.
Pillole di paracetamolo, un derivato di nitrobenzene. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe di Ottawa, Canadaderivative Work: Anrie [CC di (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons. Un altro modo per ottenere l'anilina è riducendo il nitrobenzene con monossido di carbonio (CO) in mezzo acquoso in presenza di particelle molto piccole (nanoparticelle) del paladio (PD) come catalizzatore.
C6H5-NO2 + 3 CO + H2O → c6H5-NH2 + 3 co2
Nel ottenere altri composti chimici
Il nipobenzene è il punto di partenza per ottenere un'ampia varietà di composti utilizzati come coloranti, pesticidi, farmaci e cosmetici.
 Alcuni coloranti sono ottenuti grazie al nitrobenzene. Autore: Edith Lüthi. Fonte: Pixabay.
Alcuni coloranti sono ottenuti grazie al nitrobenzene. Autore: Edith Lüthi. Fonte: Pixabay. Ad esempio, consente di ottenere 1.3-dinitrobencene che mediante clorazione (aggiunta di cloro) e la riduzione (eliminazione degli atomi di ossigeno) genera 3-cloroanilina. Questo è usato come intermediario per pesticidi, coloranti e medicine.
Il nipobenzene è stato usato per preparare un banco di ritmo che è un colorante. Inoltre, il nitrobenzene serve a preparare chinolina, azobenzene, acido menilico, dyitobenzene, isocianato o piroxilina tra molti altri composti.
In diverse applicazioni
Il nipobenzene viene usato o usato come:
Può servirti: idrocarburi insaturi- Solvente di estrazione per la purificazione degli oli lubrificanti utilizzati nei macchinari
- Solvente per eteri di cellulosa
- Ingrediente miscela per polacchi metalli
- Nei saponi
- In miscele per le scarpe polacche
- Conservatore di vernice spray
- Componente di miscela di lucidatura a pavimento
- Sostituto dell'essenza di mandorle
- Nell'industria dei profumi
- Nella produzione di gomma sintetica
- Solvente in vari processi
 Nitobenzene fa parte di alcune miscele per le scarpe polacche. D-kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/licenze/by-sa/3.0/AT/Atto.In)]. Fonte: Wikimedia Commons.
Nitobenzene fa parte di alcune miscele per le scarpe polacche. D-kuru [CC BY-SA 3.0 at (https: // creativeCommons.Org/licenze/by-sa/3.0/AT/Atto.In)]. Fonte: Wikimedia Commons. Rischi
Il nipobenzene è tossico per inalazione, ingestione e assorbimento attraverso la pelle.
Irrita la pelle, gli occhi e il tratto respiratorio. Può causare un tipo di anemia chiamata metemoglobinemia che consiste nel ridurre la capacità dei globuli rossi di rilasciare ossigeno nei tessuti e generare affaticamento.
Inoltre, il nitrobence provoca dispnea, vertigini, visione sconvolta, mancanza di respiro, collasso e morte. Danneggia anche il fegato, la milza, i reni e il sistema nervoso centrale.
Si stima che possa essere un mutageno e possibilmente causare il cancro umano, in quanto lo ha causato negli animali.
Inoltre il nitrobencene non dovrebbe essere scartato nell'ambiente. La sua tossicità per animali, piante e microrganismi lo rende molto dannoso per gli ecosistemi.
La tossicità per i microrganismi riduce la sua biodegradabilità.
Trattamenti per la sua eliminazione dell'ambiente
L'inquinamento dell'ambiente con nitrobence può verificarsi attraverso lo spreco delle varie industrie che lo usano, come l'industria da colorare o quella degli esplosivi.
Il nipobenzene è altamente tossico e difficile da rompere in condizioni naturali, per questo motivo può causare gravi sistemi di irrigazione potabile e semina.
A causa della sua elevata stabilità e tossicità nei confronti dei microrganismi, viene spesso selezionato come modello negli studi sul trattamento delle acque reflue.
Vengono studiati vari modi per eliminare il nitrobenzene d'acqua contaminato. Uno di questi è attraverso la degradazione fotocatalitica, cioè l'uso della luce solare come acceleratore della reazione di degradazione in presenza di biossido di titanio del titanio2.
 Con un reattore a luce solare è possibile eliminare l'inquinamento idrico con nitrobence. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Con un reattore a luce solare è possibile eliminare l'inquinamento idrico con nitrobence. Mihai-Cosmin Pascariu [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. I metodi di microelettrolisi sono stati anche testati con successo con un catalizzatore di ferro (fede) e rame (Cu) in ceramica. La microelettrolisi consente al nitrobenzene di decomporsi attraverso una corrente elettrica.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Nitrobenzene. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Morrison, r.T. e boyd, r.N. (2002). Chimica organica. 6a edizione. Prentice-Hall.
- Moldaveanu, s.C. (2019). Pirolisi di altri composti di conteggi di azoto. Nella pirolisi delle molecole organiche (seconda edizione). Recuperato da ScienceDirect.com.
- Smith, p.W.G. et al. (1969). Composti di nitrazione aromatica-nitro. Sostituzioni elettrofile. In chimica aromatica. Recuperato da ScienceDirect.com.
- Windholz, m. et al. (Redattori) (1983). L'indice Merck. Un eniclopedia di sostanze chimiche, farmaci e biologici. Decima edizione. Merck & co., INC.
- L'enciclopedia di chimica industriale di Ullmann. (1990). Quinta edizione. Volume A22. VCH Verlagsgellschaft MBH.
- Whang, t.-J. et al. (2012). Degradazione fotocatalitica iradiata UV di nitrobenzene mediante legame di titania sul tubo di quarzo. International Journal of PhotoEenergy, Volume 2012, articoli ID 681941. Hyndawi si è ripreso.com.
- Shikata, t. et al. (2014). Nitrobenzene Anti-Parallel Dimer Formazione in solventi non polari. AIP Advances 4, 067130 (2014). Recuperato da Doaj.org.
- Krogul-Obczak, a. et al. (2019). Riduzione del nitrobenzene in anilina da CO/H2O nel testimone delle nanoparticelle di palladio. Catalizzatori 2019, 9, 404. MDPI si è ripreso.com.
- Yang, b. et al. (2019). Produzione di scala pilota, proprietà e applicazione di Fe/Cu Catalytic-Ceramic-Filler per il trattamento delle acque reflue dei composti di nitrobenzene. Catalizzatori 2019, 9, 11. MDPI si è ripreso.com.
- « Formula di vantaggio meccanico, equazioni, calcolo ed esempi
- 110 Frasi d'amore eterne per fidanzati e mariti »

