Struttura di nitrito di sodio (Nano2), proprietà, usi, rischi

- 2773
- 865
- Zelida Gatti
Lui nitrato di sodio È un solido inorganico cristallino formato da uno ione di sodio+ e uno ione nitrito no2-. La sua formula chimica è nano2. È un solido cristallino bianco che tende ad assorbire l'acqua dall'ambiente, cioè è igroscopico.
In presenza di aria ossida lentamente il nitrato3. Ha proprietà ossidanti (altri composti ossidati) e anche riduttore (è ossidato da altri composti).
 Nitrito di sodio nano2. Aleksander Sobolowski via Wikimedia Commons [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Nitrito di sodio nano2. Aleksander Sobolowski via Wikimedia Commons [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. È presente nell'organismo dell'essere umano in modo naturale ed è usato come conservante di carni guarite e pesce affumicato in quanto evita la crescita di microrganismi dannosi.
Ha un uso importante nel trattamento di urgenza dell'avvelenamento da cianuro, poiché l'effetto tossico e letale di detto composto diminuisce. Tuttavia, deve essere somministrato con grande cautela e non funziona in tutti i casi.
È stato scoperto che potrebbe prevenire le infezioni degli occhi causate dalla contaminazione delle lenti a contatto da parte dei microrganismi. Alcuni studi indicano che il loro consumo con il cibo può causare il cancro, ma si stima che ciò possa essere evitato mangiando vitamina C con tali alimenti.
[TOC]
Struttura
Il nitrito di sodio è formato dal nazione di sodio+ E l'anione nitrito2-.
Nell'anione nitrito no2- L'azoto ha una valenza di +3 e ossigeno di -2, per questo motivo l'anione ha un singolo carico negativo globale.
Nitrito anione n2- Ha una struttura angolare, cioè i legami di azoto (N) con atomi di ossigeno (O) formano un angolo.
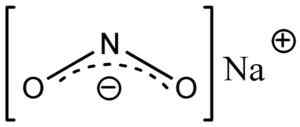 Struttura del nitrito di nano sodio2, dove puoi vedere la forma angolare dell'anione nitrito no2-. Eschenmoser [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura del nitrito di nano sodio2, dove puoi vedere la forma angolare dell'anione nitrito no2-. Eschenmoser [dominio pubblico]. Fonte: Wikimedia Commons. Nomenclatura
- Nitrato di sodio
- Nitrato di sodio
- Sale di sodio acido nitroso.
Proprietà
Stato fisico
Solido cristallino bianco giallastro. Cristalli ortorrombici.
Peso molecolare
68.995 g/mol
Punto di fusione
271 ºC
Punto di ebollizione
Non bollire. Si decompone al di sopra di 320 ºC
Può servirti: idruro di magnesio: struttura, proprietà e usiDensità
2,17 g/cm3 a 20 ºC
Solubilità
Acqua Solubile: 84,8 g/100 g di acqua a 25 ºC. Leggermente solubile in etanolo. Moderatamente solubile in metanolo. Appena solubile in dieta etere.
ph
Le sue soluzioni acquose sono alcaline, pH circa 9. Questo perché l'acido nitroso è un acido debole che tende a non dissociarsi, quindi lo ione no2- Prova a prendere un protone H+ Acqua per formare hno2, che porta alla formazione di ioni oh- Producono alcalinità.
NO2- + H2O → hno2 + OH-
Altre proprietà
Il nitrito di sodio nano2 In presenza di aria ossida lentamente il nitrato3. È un solido igroscopico, in quanto assorbe l'acqua dall'ambiente.
Ha proprietà ossidanti (può ossidare altri composti) e anche riduttori (può essere ossidato da altri composti).
Se si entra in contatto con materiali come legno, carta o tessuti, puoi farli entrare nella combustione pericolosamente.
Con gli acidi si verifica la sua decomposizione, generando una miscela di gas tossici di ossidi di azoto (noX).
Ottenimento
Può essere ottenuto riscaldando il nitrato di nano sodio3 Con PB di piombo:
Fratello maggiore3 + Pb → Nano2 + PBO
Presenza nell'organismo
L'anione nitrito è naturalmente presente nel sangue e nei tessuti, poiché è formato come conseguenza dell'ossidazione del non -.
Applicazioni
Nell'industria alimentare
È usato per adobar le carni in quanto funge da agente di ritenzione di colori e gusto e come conservante in quanto controlla la crescita dei microrganismi, evitando in particolare lo sviluppo dello sviluppo dello sviluppo Clostridium botulinum Causando malattie del botulismo.
Il nitrito di sodio nelle carni reagisce con l'emoglobina dei globuli rossi o i globuli rossi di questo cibo. È anche usato in pesce affumicato curato.
 Pesce affumicato. Autore: Reinhard Thrainer. Fonte: Pixabay.
Pesce affumicato. Autore: Reinhard Thrainer. Fonte: Pixabay. Come trattamento di emergenza nell'avvelenamento da cianuro
Il nitrito di sodio viene utilizzato per il trattamento dell'avvelenamento da cianuro acuto. È un antidoto per questo grave problema.
Può servirti: acetonitrile (C2H3N)La sua azione è dovuta al fatto che favorisce la formazione di metemoglobina (un tipo di emoglobina) nel sangue, che cattura gli ioni cianuri e non li rilascia e impedisce quindi di essere rilasciati nelle cellule, rendendoli meno tossici.
In caso di avvelenamento da cianuro, il nitrito di sodio viene applicato per via endovenosa, impiegando circa 12 minuti per generare metemoglobina. Nonostante questo ritardo, offre anche protezione per il suo effetto vasodilatatore.
 Trattamento endovenoso. Michaelberry at English Wikipedia [CC da 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons.
Trattamento endovenoso. Michaelberry at English Wikipedia [CC da 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons. Per la dilatazione dei vasi sanguigni
Serve a trattare l'ipertensione arteriosa polmonare perché agisce ritardando i vasi sanguigni abbassando così la pressione sanguigna. Si stima che questo effetto sia dovuto al fatto che si trasforma in ossido nitrico non che agisce rilassando i muscoli morbidi.
Tuttavia, le cause della loro efficacia sono ancora in studio.
Contro alcuni parassiti
Alcuni ricercatori hanno scoperto che il nitrito di sodio inibisce la crescita e la moltiplicazione del parassita intestinale Blastocystis hominis Anche se questo è resistente ad altri farmaci.
È stato scoperto che il nano2 Genera la morte di questo parassita per apoptosi, che è una specie di suicidio della cellula del parassita. Il nitrito di sodio fa sì che le cellule intestinali producano NO, il che sembra essere importante in questo processo.
Per evitare danni agli organi
Secondo alcuni studi, il nitrito è un potente inibitore del danno cardiaco e del fegato nei processi di ischemia (riduzione dell'irrigazione del sangue in una parte del corpo). Si ritiene che ciò sia dovuto al fatto che è una riserva biologica di no.
Si è concluso che può essere usato per prevenire danni agli organi dopo aver ripristinato il flusso sanguigno che è stato interrotto da un infarto, un intervento chirurgico addominale ad alto rischio o trapianto di alcuni organi.
Per evitare le infezioni per l'uso delle lenti a contatto
È stato scoperto che il nano2 impedisce la formazione di film patogeni di microrganismo Staphylococcus aureus E Pseudomonas aeruginosa Informazioni sulle lenti a contatto.
Può servirti: riduzione (chimica) Le lenti a contatto possono essere contaminate da batteri o funghi. Contatta la fotografia lente il 7 gennaio 2006. Fonte: fotografia di BPW. Fonte: Wikimedia Commons.
Le lenti a contatto possono essere contaminate da batteri o funghi. Contatta la fotografia lente il 7 gennaio 2006. Fonte: fotografia di BPW. Fonte: Wikimedia Commons. In diversi usi
Il nitrito di sodio viene utilizzato per produrre colorazione, farmaci e vari composti organici.
Funge anche da inibitore della corrosione nei grassi multipli.
Rischi o inconvenienti
Uno dei problemi dell'uso del nitrito di sodio per gli avvelenamenti del cianuro è che provoca gravi disturbi cardiovascolari nei bambini.
Non è raccomandato per le vittime di incendi in cui si verifica un'esposizione simultanea di cianuro e monossido di carbonio (CO) (CO). CO riduce la capacità del sangue di trasportare ossigeno, quindi la Nano Somministrazione2 aggraverebbe la condizione di piccolo ossigeno nel sangue del paziente.
Il nitrito di sodio inalato è irritante e tossico, può danneggiare il sistema cardiovascolare e il sistema nervoso centrale. Inoltre, è dannoso per l'ambiente.
Il nitrito di sodio ingerito con il cibo può essere dannoso. Il nitrito, al raggiungimento dello stomaco, reagisce con alcuni composti che formano nitrosamine, che possono produrre cancro.
Queste reazioni possono essere evitate in presenza di vitamina C.
Secondo alcune fonti consultate, il rischio di consumare nitriti con carni o pesci stagionati è minimo perché il nitrito è naturalmente presente in saliva.
Le fonti indicano che questo rischio è anche minimo rispetto ai grandi benefici del consumo di alimenti privi di microrganismi dannosi.
Riferimenti
- Bhattacharya, r. e flora, s.J.S. (2015). Tossicità del cianuro e il suo trattamento. In Manuale di tossicologia degli agenti di guerra chimica (seconda edizione). Recuperato da ScienceDirect.com.
- O.S. Biblioteca nazionale di medicina. (2019). Nitrato di sodio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- Kim, d.J. et al. (2017). L'efficacia antibiofilm di ossido nitrico sulla lente a contatto morbido. BMC Ophthalmol 17, 206 (2017). Estratto da bmcophthalmol.biomedcentral.com.
- Ramis-Ramos, g. (2003). Antiossidanti. Antiossidanti sintetici. In Encyclopedia of Food Sciences and Nutrition (Second Edition). Recuperato da ScienceDirect.
- Barozzi Seabra, a. e Durán, n. (2017). Donatori di ossido nitrico per il trattamento delle malattie trascurate. In donatori di ossido nitrico. Recuperato da ScienceDirect.com.
- Duranski, m.R. et al. (2005). Effetti citoprotettivi del nitrito durante l'ischemia in vivo-riperfusione del cuore e del fegato. J Clin Invest 2005; 115 (5): 1232-1240. NCBI recuperato.Nlm.NIH.Gov.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.

