Struttura, proprietà e usi KNO2 di potassio (KNO2)

- 2295
- 343
- Rufo Longo
Lui Nitrito di potassio È un sale inorganico la cui formula chimica è come2, che è chimicamente e farmacologico correlato al nitrato di potassio3. Il suo aspetto fisico è costituito da cristalli bianchi giallastri, altamente igroscopici e quindi delicati; Cioè, si dissolvono rapidamente in ambienti umidi.
La sua formula indica che la proporzione di K ioni+ e non2- È 1: 1 e rimane unito da forze elettrostatiche o da collegamenti ionici. Apparentemente le fonti naturali pure non si sono trovate per i loro cristalli, sebbene gli anioni Niter possano essere trovati in terreni, fertilizzanti, piante e animali.
 Cristalli nitali di potassio. Fonte: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Cristalli nitali di potassio. Fonte: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] L'immagine superiore mostra come sembrano i cristalli di Kno2, Con toni gialli pronunciati. Se questi cristalli vengono lasciati a contatto con l'aria, assorbiranno l'umidità per diventare una soluzione acquosa; soluzione che ha generato controversie rispetto al fatto che il suo utilizzo sia o meno benefico o meno.
D'altra parte, i suoi cristalli, in quantità molto piccole (200 ppm), sono usati per salinizzare le carni e garantire la loro conservazione contro l'azione batterica. Inoltre, il kno2 Migliora il colore delle carni, trasformandole più rossastre; Tuttavia, è soggetto a diverse restrizioni per evitare gli effetti tossici di questo sale sul corpo.
[TOC]
Struttura di nitrito di potassio
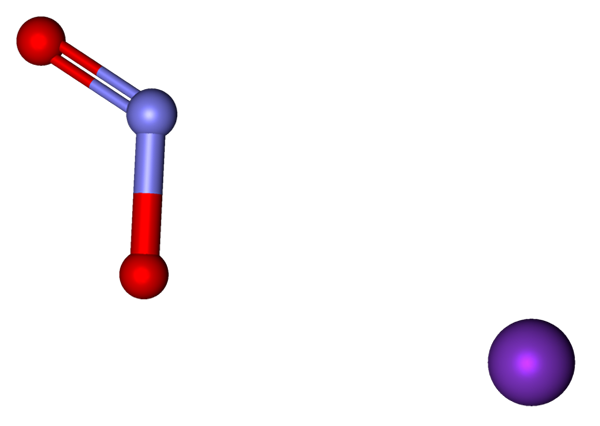 Ioni che compongono il kno2 rappresentato con un modello di sfere e barre. Fonte: Marinavladivok [CC0].
Ioni che compongono il kno2 rappresentato con un modello di sfere e barre. Fonte: Marinavladivok [CC0]. Gli ioni presenti in nitrito di potassio sono mostrati sopra. Il cation k+ corrisponde alla sfera viola, mentre l'anione no2- È rappresentato dalle sfere bluastre e rosse.
L'anione no2- Viene mostrato con un doppio legame e uno semplice [o = n-o]-; Ma in realtà, entrambi i collegamenti sono gli stessi a seguito della risonanza del carico negativo tra loro.
Gli ioni K+ e non2- Si attirano a vicenda nello spazio per organizzare un modello strutturale con la minima energia; Questo è, dove le repulsioni tra i carichi uguali sono minimi. E così i cristalli Kno credono2, la cui cella unitaria è suscettibile alle variazioni di temperatura, in cui transizioni di fase.
Può servirti: Stanislao CannizzaroAd esempio, a basse temperature (meno di 25 ° C) i cristalli KNO2 Adotta un sistema monoclinico (Fase I). Quando la temperatura supera i 25 ° C, si verifica una transizione di fase monoclinica romboébica (Fase II). Infine, sopra i 40 ° C i cristalli Kno2 Modifica in Cubic (Fase III).
Inoltre, il kno2 può presentare altre fasi cristalline (fasi IV, V e VI) sotto elevate pressioni. Con questo, i ioni K+ e non2- Finiscono per muoversi e ordinati in diversi modi nei loro cristalli puri.
Proprietà
Massa molecolare
85.1038 g/mol.
Densità
1.9150 g/ml.
Punto di fusione
440,02 ° C (ma inizia a rompersi da 350 ° C, emettendo fumi tossici).
Punto di ebollizione
537 ° C (esplosione).
Solubilità dell'acqua
312 g/ 100 g di acqua a 25 ° C.
Delicuescence
La sua solubilità in acqua è tale che è igroscopica; Tanto, questo presenta delicoscenza, assorbendo un'umidità sufficiente per dissolversi. Questa affinità per l'acqua può essere dovuta alla stabilità energetica che i K ioni ottengono+ Quando idratante, oltre a un'entalpia di rete cristallina bassa per i cristalli KNO2.
I cristalli possono assorbire l'acqua senza dissolversi per diventare un idrato2· H2O. In idratato la molecola d'acqua sta accompagnando gli ioni, che modifica la struttura cristallina.
Questo idrato (o molti di essi) può essere formato al di sotto di -9 ° C; A una temperatura più elevata, l'acqua dissolve e idrata gli ioni, deformando il vetro.
Solubilità in altri solventi
Leggermente solubile in alcoli caldi e molto solubile in ammoniaca.
ph
6-9. Le sue soluzioni acquose sono quindi alcaline, poiché l'anione no2- Può idrolidizzare.
Nomenclatura
A kno2 Può anche essere nominato in altri modi. "Nitrito di potassio" corrisponde al nome di questo sale in base alla nomenclatura di serie; 'Potassio nitrito', secondo la nomenclatura sistematica, in cui viene evidenziata l'unica valenza di potassio, +1; e diossonitrato (III) di potassio, secondo la nomenclatura sistematica.
Può servirti: Dibenzalacetona: proprietà, meccanismo di reazione, usi, rischiIl diossonitrato di potassio (III), evidenzia la valenza +3 dell'atomo di azoto. Anche il nome più consigliato dall'IUPAC per il kno2, 'Potassio nitrito' continua ad essere il più comodo e il più facile da ricordare.
Ottenimento
Il modo più diretto per sintetizzarlo, ma con prestazioni più basse, è attraverso la decomposizione termica di nitrato di potassio o salsa a 400 ° C o più:
2kno3 => Kno2 + O2
Tuttavia, parte del kno2 finisce per decomposizione per calore, oltre ad altri prodotti.
Un altro metodo per prepararlo o sintetizzarlo con prestazioni più elevate è riducendo il kno3 In presenza di piombo, rame o zinco. L'equazione per questa reazione è la seguente:
Kno3 + Pb => kno2 + PBO
Il potassio e il nitrato di piombo sono miscelati stechiometricamente in una padella di ferro, dove si fondono con costante agitazione e riscaldamento per mezz'ora. L'ossido di piombo (II) è giallo e l'impasto risultante è caldo e trattato con acqua bollente. Quindi i filtri della miscela calda.
Le bolle di filtro a caldo con anidride carbonica per cinque minuti, che precipiteranno al carbonato di piombo, PBCO3, insolubile. In questo modo il vantaggio è finito. L'acido nitrico diluito al filtro viene aggiunto fino a quando il pH non è neutro, è consentito raffreddare e infine l'acqua evapora in modo che si formino i cristalli di kno2.
Applicazioni
Additivo e reagente
Il nitrito di potassio viene usato come additivo per curare le carni rosse, mantenendo il loro gusto e più colore durante la conservazione, mentre ritarda l'azione batterica e alcune tossine, come la botulinica. Pertanto, mostra un'azione antibatterica.
Il kno2 Non si ossida, il che reagisce con la mioglobina della carne e, di conseguenza, finisce per modificare il suo colore rosso naturale. Quindi, quando la carne viene cotta, acquisisce il suo caratteristico colore rosa forte.
Può servirti: 20 esempi di sublimazione chimica e caratteristicheTuttavia, in condizioni senza specificare il kno2 reagisce con le proteine della carne per dare origine alla nitrosamina, che può diventare cancerogena.
D'altra parte, il kno2 (Sebbene preferibilmente nano2) È un reagente analitico che può essere usato nella sintesi di coloranti azoici (la reazione di acido nitroso con ammine aromatiche) e nell'analisi degli aminoacidi.
Antidoto
Mentre ha i suoi effetti negativi, kno2 Agisce come un antidoto in pazienti avvelenati con cianuri e idrogeno solforato. Il suo meccanismo è ossidare i centri di fede2+ alla fede3+ Dei gruppi che abbiamo delle emoglobine, producendo metemoglobina, che poi reagisce con gli anioni CN- e hs-.
Medici
Nel succo gastrico dello stomaco l'anione no2- È ridotto a no, che è noto per avere un'azione vasodilatatrice, aumentando il flusso sanguigno. In altre regioni del corpo in cui il pH non è sufficiente acido, alcuni enzimi, come la xanthina ossidortetta, sono responsabili della riduzione del non -2-.
Kno è stato usato2 Per trattare disturbi e malattie come l'angina toracica ed epilessia (con effetti collaterali molto negativi).
Riferimenti
- Wikipedia. (2019). Nitrito di potassio. Recuperato da: in.Wikipedia.org
- Prebchem. (2016). Preparazione nitrito di potassio. Recuperato da: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Nitrato inorganico e nitrito e controllo della pressione sanguigna, ricerca cardiovascolare, volume 89, numero 3, 15 febbraio 2011, pagine 492-498, doi.org/10.1093/CVR/CVQ309
- PUBCHEM. (2019). Nitrito di potassio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Formulazione chimica. (2018). Nitrito di potassio. Recuperato da: formulazione Quimica.com
- National Center for Advancing Translational Sciences. (2011). Nitrito di potassio. Recuperato da: droghe.ncats.Io
- Richard J. Eley, Paul B. Addis e Joseph J. Wartheen. (1992). Nitrito nella carne. Università del Minnesota.
- N. R. Rao, b. Prakash e M. Natarajan. (1975). Trasformazioni della struttura cristallina in nitriti, nitrati e carbonati inorganici. Dipartimento di Chimica, Indian Institute of Technology, Kanpur, India.
- « Caratteristiche del linguaggio politico, tipi, questioni ed esempi
- Cause di inquinamento della spazzatura, conseguenze ed esempi »

