Nitrato di potassio (KNO3)
- 3909
- 1178
- Rosolino Santoro
Cos'è il nitrato di potassio?
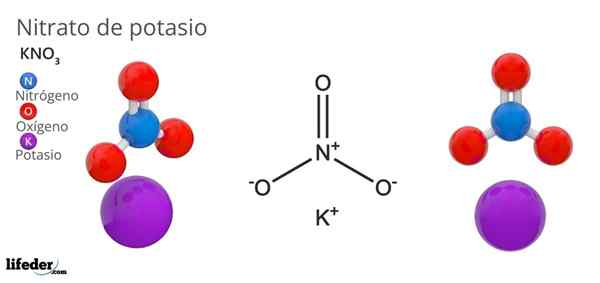
Lui nitrato di potassio È un sale ternario composto da potassio, metallo alcalino e ossoanione di nitrato. La sua formula chimica è kno3, Il che significa che per ogni k ione+, Non c'è ione3-- interagendo con questo. Pertanto, è un sale ionico e costituisce uno dei nitrati alcalini (lino3, Fratello maggiore3, Rbno3...).
Il kno3 È un forte agente ossidante a causa della presenza di nitrato. Cioè, funziona come una riserva di ioni nitrati solidi, a differenza di altri sali altamente solubili in acqua o molto igroscopica. Molte proprietà e usi di questo composto sono dovuti all'anione del nitrato, piuttosto che al catione di potassio.
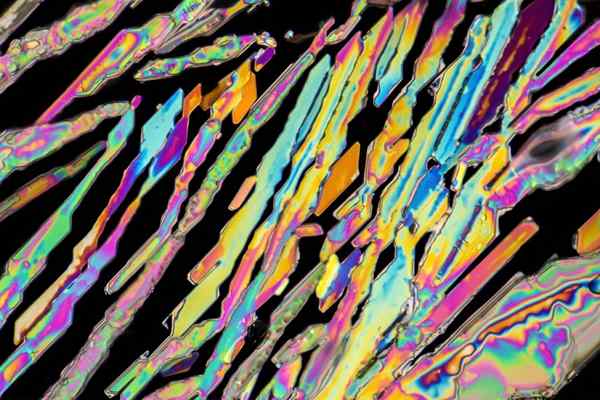 Cristalli di nitrato di potassio
Cristalli di nitrato di potassio Nell'immagine superiore sono illustrati alcuni cristalli di kno3 con forme di ago. La fonte naturale di kno3 è il saltpeter, noto come i nomi Salnitro O Palloncino, in inglese. Questo elemento è anche noto come nitrato di potassa o minerale nitro.
Si trova in aree aride o desertiche, nonché efflorescenze delle pareti cavernose. Un'altra importante fonte di kno3 È il guano, escrementi di animali che abitano ambienti asciutti.
Struttura chimica del nitrato di potassio
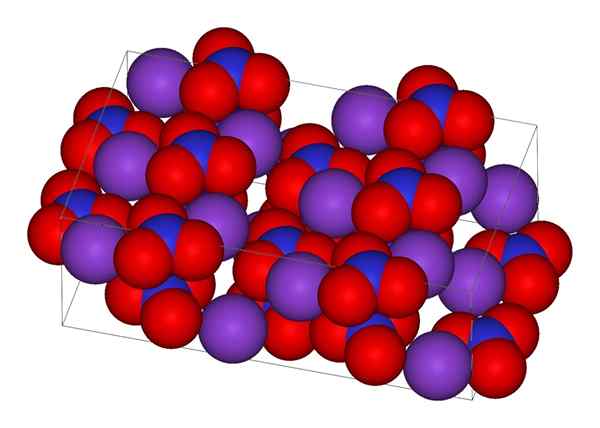 Struttura cristallina di nitrato di potassio
Struttura cristallina di nitrato di potassio Nell'immagine superiore è rappresentata la struttura cristallina del kno3. Le sfere viola corrispondono a K ioni+, Mentre il rosso e il blu sono atomi di ossigeno e azoto, rispettivamente. La struttura cristallina è ortorrombica a temperatura ambiente.
Nion Geometry n3- È quello di un piano trigonale, con gli atomi di ossigeno nei vertici del triangolo e l'atomo di azoto al centro. Presenta un carico formale positivo nell'atomo di azoto e due carichi formali negativi in due atomi di ossigeno (1-2 = (-1)).
Può servirti: microscopio sempliceQueste due cariche negative di NO3- Si trasferiscono tra i tre atomi di ossigeno, mantenendo sempre il carico positivo in azoto. Come conseguenza di quanto sopra, i ioni K-+ del cristallo evitano di essere appena sopra o sotto l'azoto degli anioni3-.
In effetti, l'immagine dimostra come i k ioni+ Sono circondati da atomi di ossigeno, sfere rosse. In conclusione, queste interazioni sono responsabili delle disposizioni cristalline.
Altre fasi cristalline
Le variabili come la pressione e la temperatura possono modificare queste disposizioni e causare diverse fasi strutturali per il KNO3 (Fasi I, II e III). Ad esempio, la fase II è quella dell'immagine, mentre la fase I (con struttura cristallina trigonale) si forma quando i cristalli vengono riscaldati fino a 129 ºC.
La fase III è un solido di transizione ottenuto dal raffreddamento della fase I e alcuni studi hanno dimostrato che presenta alcune importanti proprietà fisiche, come la ferroelettricità. In questa fase gli strati e nitrati di potassio, possibilmente sensibili alle repulsioni elettrostatiche tra ioni.
Negli strati di Fase III gli anioni no3- Perdono un po 'della loro planarità (le curve del triangolo leggermente) per consentire questa disposizione, che, prima di qualsiasi disturbo meccanico, diventa la struttura della fase II.
Usi/applicazioni di nitrato di potassio
Il sale è di grande importanza, poiché viene utilizzato in numerose attività dell'uomo, che si manifestano nell'industria, nell'agricoltura, nel cibo, ecc. Questi usi includono quanto segue:
- Preservazione alimentare, in particolare carne. Nonostante il sospetto che intervenga nella formazione di nitrosamina (agente cancerogeno) è ancora utilizzato in carbone.
- Fertilizzante, perché il nitrato di potassio fornisce due delle tre piante macronutrienti: azoto e potassio. Insieme al fosforo, questo elemento è necessario per lo sviluppo delle piante. Cioè, è una riserva importante e gestibile di questi nutrienti.
- Accelera la combustione, essere in grado di produrre esplosioni se il materiale combustibile è esteso o se è finemente diviso (maggiore superficie, maggiore reattività). Inoltre, è uno dei componenti principali della polvere da sparo.
- Facilita la rimozione dei tocchi degli alberi ceduti. Il nitrato fornisce l'azoto necessario per i funghi per distruggere il bosco di ceppi.
- Interviene nella riduzione della sensibilità dentale attraverso la sua incorporazione nelle dentifri, il che aumenta la protezione di sensazioni dolorose del dente prodotte da freddo, calore, acido, dolci o contatti.
- Interviene come un ipotensore nella regolazione della pressione sanguigna nell'uomo. Questo effetto verrebbe dato o correlato con un cambiamento nell'escrezione di sodio. La dose raccomandata nel trattamento è 40-80 meq/giorno di potassio. A questo proposito, si sottolinea che il nitrato di potassio avrebbe un'azione diuretica.
Sintesi
La maggior parte del nitrato è prodotto nelle miniere dei deserti in Cile. Può essere sintetizzato da diverse reazioni:
NH4NO3 (AC) +KOH (AC) => NH3 (AC) +Kno3 (AC)+H2O (l)
Nitrato di potassio neutralizza anche acido nitrico con idrossido di potassio in una reazione altamente esotermica.
KOH (AC) +HNO3(conc) => kno3 (AC) +H2O (l)
Su scala industriale, il nitrato di potassio è prodotto da una reazione a doppia spostamento.
Fratello maggiore3 (AC) +KCl (AC) => NaCl (AC) +KNO3 (AC)
La fonte principale del KCL è di Silvina Mineral, e non altri minerali come carnite o cainite, che sono anche composti da magnesio ionico.
Proprietà fisiche e chimiche
Il nitrato di potassio in stato solido è presentato come un bianco o sotto forma di cristalli di struttura ortorombica a temperatura ambiente e trigonale a 129 ºC. Ha un peso molecolare di 101.1032 g/mol, è un bagno e ha un sapore di acri salini.
È un composto molto solubile in acqua (316-320 g/litro di acqua, a 20 ° C), a causa della sua natura ionica e della facilità di molecole d'acqua per risolvere il k ione k+.
La sua densità è 2,1 g/cm3 a 25 ºC. Ciò significa che è circa due volte denso dell'acqua.
I suoi punti di fusione (334 ºC) e l'ebollizione (400 ºC) sono indicativi dei legami ionici tra K+ e non3-. Tuttavia, sono bassi rispetto a quelli di altri sali, poiché l'energia reticolare cristallina è inferiore per gli ioni monovalenti (cioè, con carichi ± 1) e non hanno anche dimensioni molto simili.
Può servirti: indicatori di pHSi decompone a una temperatura vicino al punto di ebollizione (400 ° C) per produrre potassio e ossigeno molecolare:
Kno3(S) => kno2(s) + o2(G)
Riferimenti
- PUBCHEM. (2018). Nitrato di potassio. Recuperato da Pubchem.NCBI.Nlm.Nik.Gov
- Cryst Act. (2009). Crescita e raffinamento a cristallo singolo di nitrato di potassio di fase III, KNO3. B65, 659-663.
- Marni Wolfe. (3 ottobre 2017). Rischi di nitrati di potassio. Livestrong si è ripreso.com
- Ametista Galleries, Inc. (1995-2014). Il Niter minerale. Gallerie recuperate.com