Nitrato di rame (II)
- 2714
- 585
- Dante Morelli
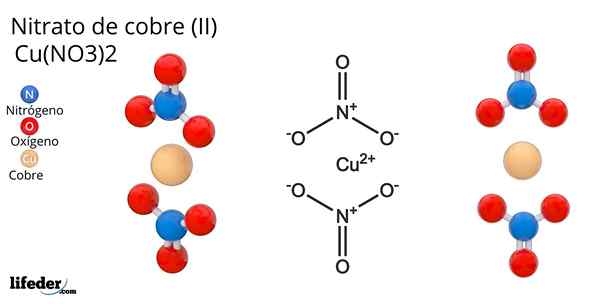
 Formula e struttura del nitrato di rame (II)
Formula e struttura del nitrato di rame (II) Lui nitrato di rame (Ii) o nitrato cupric, la cui formula chimica è Cu (no3)2, È un brillante sale inorganico e attraenti colori blu-verde. È sintetizzato su scala industriale dalla decomposizione dei minerali di rame, tra cui Gerhardita e Minerali Rouaita.
Altri metodi più fattibili, in termini di materia prima e quantità desiderate di sale, consistono in reazioni dirette con rame metallico e suoi composti derivati. Quando il rame è in contatto con una soluzione concentrata di acido nitrico (HNO3), si verifica una reazione redox.
In questa reazione si ossida il rame e l'azoto viene ridotto secondo la seguente equazione chimica:
Cu (s) + 4hno3(conc) => cu (no3)2(AC) + 2H2O (l) + 2no2(G)
Biossido di azoto (no2) è un gas marrone e dannoso; La soluzione acquosa risultante è bluastra. Il rame può formare lo ione cuproso (Cu+), Lo ione cupric (Cu2+) o il Cu ione meno comune3+; Tuttavia, lo ione cuproso non è favorito nei media acquosi da molti fattori elettronici, energetici e geometrici.
Il potenziale di riduzione standard per Cu+ (0,52 V) è maggiore rispetto a Cu2+ (0,34 V), il che significa che il Cu+ È più instabile e tende a vincere un elettrone per diventare CU (s). Questa misura elettrochimica spiega perché non c'è cuno3 come prodotto della reazione, o almeno in acqua.
[TOC]
Proprietà di nitrati di rame
 Trioidrato di nitrato di rame (II)
Trioidrato di nitrato di rame (II) Il nitrato di rame è anidride (secco) o idratato con diverse proporzioni di acqua. L'anidride è un liquido blu, ma dopo aver coordinato con molecole d'acqua - in grado di formare ponti idrogeno - cristallizza come Cu (NO3)2· 3h2O o cu (no3)2· 6h2O. Queste sono le tre forme di sale più disponibili sul mercato.
Può servirti: Helmholtz Free Energy: unità, come viene calcolato e risolto eserciziIl peso molecolare per il sale secco è 187,6 g/mol, aggiungendo a questo valore 18 g/mol per ciascuna molecola d'acqua incorporata nel sale. La sua densità è uguale a 3,05 g/ml e diminuisce per ogni molecola d'acqua incorporata: 2,32 g/mL per sale tri-idratato e 2,07 g/mL per sale hexa. Non ha un punto di ebollizione, ma sublima.
Le tre forme di nitrato di rame sono altamente solubili in acqua, ammoniaca, diossano ed etanolo. I suoi punti di fusione scendono mentre un'altra molecola viene aggiunta alla sfera di coordinazione esterna del rame; La fusione è seguita dalla decomposizione termica del nitrato di rame, producendo i gas dannosi di NO2:
2 cu (no3)2(s) => 2 CUO (s) + 4 no2(g)+ o2(G)
L'equazione chimica sopra è per il sale anidride; Per i sali idratati, si verificherà anche vapore acqueo sul lato destro dell'equazione.
Configurazione elettronica
Configurazione elettronica per ioni Cu2+ È [ar] 3d9, Presentazione del paramagnetismo (l'elettrone nell'orbitale 3D9 è scomparso).
Poiché il rame è un metallo di transizione del quarto periodo della tavola periodica e avendo perso due dei suoi elettroni di Valencia per azione dell'HNO3, Ha ancora 4s e 4p orbitali disponibili per formare legami covalenti. Ancora di più, il CU2+ Puoi usare due dei suoi orbitali 4D più esterni per essere in grado di coordinare fino a sei molecole.
Gli anioni no3- Sono piatti e per il CU2+ Puoi coordinarti con loro deve avere un'ibridazione SP3D2 Ciò ti consente di adottare una geometria ottaedrica; Questo impedisce agli anioni di no3- Sii "hit" tra loro.
Può servirti: formula condensata: cosa è ed esempi (metano, etano, glucosio ...)Ciò è ottenuto da Cu2+, posizionarli in un piano quadrato intorno a se stesso. La configurazione risultante per l'atomo di Cu all'interno del sale è: [AR] 3D94s24p6.
Struttura chimica
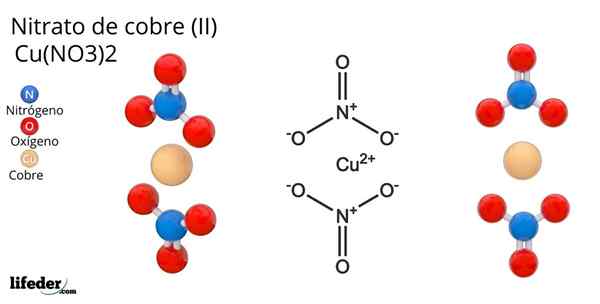
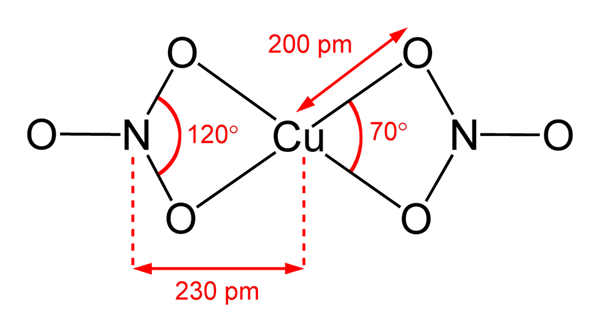 Struttura del nitrato di rame (II)
Struttura del nitrato di rame (II) Nell'immagine superiore è rappresentata una molecola isolata di Cu (no3)2 in una fase gassosa. Gli atomi di ossigeno anionico di nitrati sono coordinati direttamente con il centro di rame (sfera di coordinamento interno), formando quattro legami Cu-O.
Ha una geometria molecolare piana quadrata. Il piano è disegnato dalle sfere rosse nei vertici e dalla sfera di rame al centro. Le interazioni di fase gassosa sono molto deboli a causa di repulsioni elettrostatiche tra gruppi non3-.
Tuttavia, in fase solida i centri di rame formano collegamenti metallici -cu-cu-, creazione di catene rame polimeriche.
Le molecole d'acqua possono formare ponti idrogeno con gruppi no3-, e questi offriranno ponti idrogeno per altre molecole d'acqua, e così via fino a una sfera d'acqua intorno al CU (no3)2.
In questa sfera può avere da 1 a 6 vicini esterni; Quindi il sale è facilmente idratato per generare sali di tri ed hexa idratati.
Il sale è formato da un Cu ionico2+ e due ioni no3-, Concedere una caratteristica cristallinità di composti ionici (ortorrombico per sale anidrid, romboédica per sali idratati). Tuttavia, i collegamenti hanno un carattere più covalente.
Usi/applicazioni
Per gli affascinanti colori del nitrato di rame, questo sale trova l'uso come additivo in ceramica, su superfici metalliche, in alcuni fuochi d'artificio e anche nel settore tessile come mordente.
Può servirti: entalpyÈ una buona fonte di ionico per molte reazioni, in particolare quelle in cui catalizza le reazioni organiche. Trova anche usi simili ad altri nitrati, sia come fungicida, erbicida che come conservante in legno.
Un altro dei suoi usi principali e più nuovi è nella sintesi di catalizzatori CUO o materiali con qualità fotosensibili.
Viene anche usato come reagente classico nei laboratori di insegnamento per mostrare reazioni all'interno delle cellule voltaiche.
Rischi
- È un agente fortemente ossidante, dannoso per l'ecosistema marino, irritante, tossico e corrosivo. È importante evitare tutto il contatto fisico direttamente con il reagente.
- Non è infiammabile.
- Si decompone ad alte temperature rilasciando gas irritanti, tra questi2.
- Nell'organismo umano può causare danni cronici al sistema cardiovascolare e nervoso centrale.
- Può causare irritazioni nel tratto gastrointestinale.
- Essere un nitrato, all'interno del corpo diventa nitrito. Il nitrito solleva devastazioni nei livelli di ossigeno nel sangue e nel sistema cardiovascolare.
Riferimenti
- Giorno, r., & Underwood, a. Chimica analitica quantitativa (Quinto ed.). Pearson Prentice Hall, P-810.
- Mel Science. (2015-2017). Mel Science. Recuperato da Mel Science: Melscience.com
- ResearchGate GmbH. (2008-2018). Sportello di ricerca. Recuperato da ResearchGate: ResearchGate.netto
- Laboratorio scientifico. Laboratorio scientifico. Recuperato da Science Lab: Sciencelab.com
- Whitten, Davis, Peck e Stanley. (2008). Chimica (Ottava ed.). P-321. Apprendimento del Cengage.
- Wikipedia. Wikipedia. Wikipedia recuperato: in.Wikipedia.org

