Nitrato di calcio (Ca (NO3) 2)

- 2811
- 289
- Brigitta Ferrari
Lui nitrato di calcio È un sale inorganico terziario la cui formula chimica è CA (no3)2. Dalla sua formula è noto che il suo solido è composto da ioni Ca2+ e non3- In una proporzione 1: 2. Pertanto, è un composto di natura puramente ionica.
Una delle sue proprietà è il suo carattere ossidante, seguendo l'anione del nitrato. Non è carburante, cioè non brucia ad alte temperature. Essendo non combustibile, rappresenta un solido sicuro per manipolarlo senza gravi cure; Tuttavia, può accelerare l'accensione dei materiali combustibili.
 Nitrato di calcio solido. Fonte: Ondřej Mangl [dominio pubblico], di Wikimedia Commons
Nitrato di calcio solido. Fonte: Ondřej Mangl [dominio pubblico], di Wikimedia Commons Il suo aspetto è costituito da solido granulare, che presenta un colore bianco chiaro o grigio (immagine superiore). Può essere anidro o tetraidrato, CA (no3)2· 4h2O. È molto solubile in acqua, metanolo e acetone.
Il nitrato di calcio è stato ampiamente usato come fertilizzante, poiché si muove facilmente nel terreno umido ed è rapidamente assorbito dalle radici delle piante. Fornisce due elementi importanti per la nutrizione e la crescita delle piante: azoto e calcio.
L'azoto è uno dei tre elementi essenziali per lo sviluppo delle piante (N, P e K), è essenziale nella sintesi proteica. Nel frattempo, il calcio è necessario per mantenere la struttura della parete cellulare delle piante. Per questo motivo la CA (no3)2 I giardini sono molto destinati.
D'altra parte, questo sale ha azioni tossiche, in particolare per contatto diretto con la pelle e gli occhi, nonché per inalare la sua polvere. Inoltre, può essere suddiviso dal riscaldamento.
Struttura del nitrato di calcio
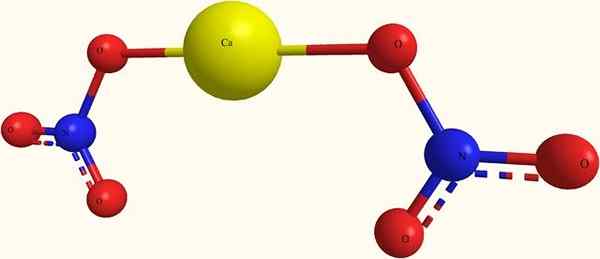 Ioni di nitrato di calcio. Fonte: я.Hardnox a ru.Wikipedia [dominio pubblico], di Wikimedia Commons
Ioni di nitrato di calcio. Fonte: я.Hardnox a ru.Wikipedia [dominio pubblico], di Wikimedia Commons Nell'immagine superiore la struttura della ca (no3)2 In un modello di sfere e barre. Qui, tuttavia, c'è un difetto: si assume l'esistenza di legami covalenti Ca-O, che contraddice il suo carattere ionico. Chiarindolo, le interazioni sono davvero del tipo elettrostatico.
Il cation ca2+ È circondato da due anioni no3- Secondo le sue proporzioni nel vetro. Predomina azoto sotto forma di nitrato nella struttura cristallina.
Gli ioni sono raggruppati in modo tale da stabilire una configurazione la cui espressione minima è la cella unitaria; che, per il sale anidro, è cubico. Cioè dai cubi contenenti la proporzione 1: 2 per questi ioni, viene riprodotto l'intero vetro.
Può servirti: stagno: struttura, proprietà, ottenimento, usiD'altra parte, il sale tetraidrato, CA (no3)2· 4h2Oppure ha quattro molecole d'acqua per ogni set3- AC2+ NO3-. Ciò modifica la struttura cristallina, deformandola in una cellula monoclinica unitaria.
Pertanto, i cristalli per entrambi i sali, anidro e tetraidrato, sono diversi; Differenze che possono essere determinate nelle loro proprietà fisiche, ad esempio punti di fusione.
Proprietà fisiche e chimiche
Nomi chimici
-Nitrato di calcio
-Dinitrato di calcio
-Nitrocalcita
-Norwegian Salitre e Limesaltpetro.
Formula molecolare
Becco3)2 o può2O6
Peso molecolare
Anhidro 164.088 g/mol e tetraidrato 236,15 g/mol. Notare l'effetto dell'acqua sul peso molecolare e non può essere disprezzato quando si rende pesante.
Aspetto fisico
Granuli solidi o grigio chiaro. Cristalli bianchi cubici o deliziosi granuli; Cioè, assorbono l'umidità al punto da dissolvere il prodotto della loro elevata solubilità.
Punto di ebollizione
La forma anidra si decompone riscaldando a una temperatura che impedisce la determinazione del suo punto di ebollizione; Mentre il sale tetraidrato ha un punto di ebollizione di 132 ºC (270 ºF, 405 K).
Punto di fusione
-Forma Anhydra: da 561 ºC a 760 mmHg (1042 ºF, 834 K).
-Forma di tetraidrate: 42,7 ºC (109 ºF, 316 K).
Ciò dimostra come le molecole d'acqua interferiscono con le interazioni elettrostatiche tra la CA2+ e non3- all'interno dei cristalli; E di conseguenza, il solido si scioglie a una temperatura molto più bassa.
Solubilità dell'acqua
-Forma Anhydra: 1212 g/L a 20 ºC.
-Forma di tetraidrate: 1290 g/L a 20 ºC.
L'acqua in cristalli aumenta a malapena la solubilità del sale.
Solubilità nei solventi organici
-In etanolo, 51,42 g/100 g a 20 ºC.
-In metanolo, 134 g/100 g a 10 ºC.
-Nell'acetone, 168 g/100 g a 20 ºC.
Acidità (PKA)
6.0
Densità
2,5 g/cm3 a 25 ºC (tetraidrato).
Decomposizione
Quando il nitrato di calcio viene riscaldato all'incandescenza, si decompone in ossido di calcio, ossido di azoto e ossigeno.
Profilo reattivo
È un agente fortemente ossidante, ma non è carburante. Accelera l'accensione dei materiali combustibili. La divisione del nitrato di calcio in particelle fini, facilita la sua esplosione quando il composto è esposto a un incendio prolungato.
Può servirti: leghe non ferrose: struttura, proprietà, usi, esempiLe miscele con esteri alchilici diventano esplosivi causando esteri alchil nitrati. La combinazione di nitrato di calcio con fosforo, cloruro di stagno (II) o altro agente riducente, può reagire in modo esplosivo.
Applicazioni
agricoltura
È usato nelle colture come fonte di azoto e calcio. Il nitrato di calcio è molto solubile nell'acqua e facilmente assorbito dalle radici delle piante. Inoltre, non acidifica i terreni perché i loro ioni non possono idrolizzare in modo significativo.
La sua miscela dovrebbe essere evitata con fertilizzanti contenenti fosforo o solfato, per evitare la formazione di sali insolubili. Seguendo la tua igroscopicità, deve essere immagazzinato in un ambiente secco e fresco.
Il suo uso ha un vantaggio rispetto all'uso del nitrato di ammonio come fertilizzante. Mentre quest'ultimo composto porta azoto alle piante, interferisce con l'assorbimento di calcio, che potrebbe produrre una carenza di calcio nelle piante.
Il calcio contribuisce al mantenimento della struttura della parete cellulare della pianta. In presenza di una carenza di calcio, i tessuti nella formazione delle piante, come le punte delle radici, le foglie giovani e le punte degli scoppi, spesso mostrano una crescita distorta.
Diminuzione dell'ammonio
Il nitrato di calcio riduce l'accumulo di acidi grassi volatili e composti fitotossici fenolici che si accumulano dalla decomposizione dei colture di soia rifiuti.
Inoltre, esiste una tendenza al nitrato di calcio per ridurre la concentrazione di ammonio nel terreno, che aumenta la capacità di smorzamento dell'idrogeno.
Calcestruzzo
Il nitrato di calcio viene utilizzato per ridurre il tempo di impostazione del calcestruzzo. Questo è prodotto dalla generazione di idrossido di calcio, forse da una reazione a doppia spostamento.
Inoltre, il nitrato di calcio induce la generazione del composto di idrossido di ferro, la cui azione protettiva del calcestruzzo ne riduce la corrosione. Cioè, il ferro presente può reagire con i componenti di base del calcestruzzo, come lo stesso idrossido di calcio.
Il nitrato di calcio riduce il tempo di impostazione, nonché la resistenza del calcestruzzo, a cui sono state aggiunte le ceneri vulcaniche. Per studiare l'effetto dell'aggregato di nitrato di calcio al calcestruzzo, sono state utilizzate concentrazioni crescenti di nitrato di calcio, tra il 2% e il 10%.
Può servirti: frazione molare: come viene calcolato, esempi, eserciziÈ stata osservata una maggiore riduzione del tempo di impostazione, nonché un aumento della resistenza al calcestruzzo poiché la concentrazione di nitrato di calcio è aumentata al 10%.
Fognatura o trattamento dei rifiuti
Il nitrato di calcio viene utilizzato per ridurre i cattivi odori delle acque reflue, diminuendo l'idrogeno solforato. Inoltre, la materia organica che genera condizioni anaerobiche che ostacola la sopravvivenza di molte specie biologiche viene consumata.
Preparazione a freddo
Il nitrato di calcio tetraidrato è un composto endotermico, cioè ha la capacità di assorbire il calore dall'ambiente che lo circonda. Questo produce un raffreddamento dei corpi che entrano in contatto con i contenitori che lo contengono.
I comprimenti aumentano la loro temperatura e per rigenerarli, è sufficiente metterli in un congelatore
Coagulazione in lattice
Il nitrato di calcio viene utilizzato nella fase di coagulazione del lattice. Fa parte della soluzione di immersione e quando entra in contatto con la soluzione che il lattice contiene, rompe la sua stabilizzazione e provoca la sua coagulazione.
Trasferimento di calore e conservazione
Viene utilizzata la miscela binaria di sali di nitrati fusi, incluso il calcio con altri nitrati al posto dell'olio termico negli impianti di energia solare per il trasferimento di calore e lo stoccaggio.
Forme di applicazione
-Il nitrato di calcio miscelato con il terreno viene applicato a una concentrazione di 1,59 kg per 30,48 m2, con un'adeguata irrigazione. Il nitrato di calcio viene solubilizzato nell'acqua, consentendo il suo assorbimento dalle radici della pianta. Nelle colture idroponiche si dissolve nell'acqua di coltivazione.
-Il nitrato di calcio a forma di spray viene anche usato per spruzzare le foglie e i fiori, essendo un trattamento efficace nella prevenzione del marciume del fiore di pomodoro, il punto di sughero e il foro amaro della mela.
-Viene aggiunto alla miscela di formazione in cemento (cemento, sabbia, pietre e acqua) una quantità di nitrato di calcio e l'effetto dell'IT ha sulle proprietà specifiche del calcestruzzo; come impostazione della velocità e della resistenza.
-Il nitrato di calcio viene aggiunto a una concentrazione adeguata per ridurre i cattivi odori di liquami o residui, a un livello che gli odori sono tollerabili per le persone.
Riferimenti
- Specifiche di nitrato di calcio. Recuperato da: Direct2farmer.com
- Nitrato di calcio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- « Cosa sono, tipi, caratteristiche, caratteristiche
- Storia e significato della bandiera indonesiana »

