Passaggi del metodo di bilanciamento redox, esempi, esercizi
- 3536
- 766
- Dott. Rodolfo Gatti
Lui Metodo di bilanciamento redox È uno che consente di bilanciare le equazioni chimiche delle reazioni redox, che altrimenti sarebbe un mal di testa. Qui uno o più specie scambiano elettroni; Quello che dona o li perde si chiama specie ossidante, mentre quella che le accetta o vince, una specie riduttiva.
In questo metodo è essenziale conoscere il numero di ossidazione di queste specie, poiché rivelano quanti elettroni hanno guadagnato o perso da Mol. Grazie a ciò, è possibile bilanciare le spese elettriche scrivendo nelle equazioni gli elettroni come se fossero reagenti o prodotti.
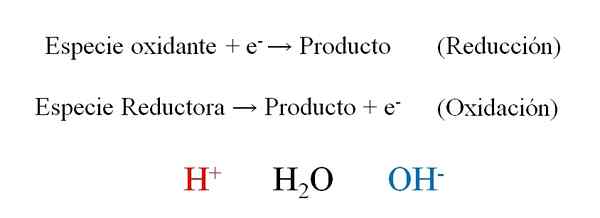
 Semi -reazioni generali di una reazione redox con i tre protagonisti durante il loro bilanciamento: H+, H2O e OH-. Fonte: Gabriel Bolívar.
Semi -reazioni generali di una reazione redox con i tre protagonisti durante il loro bilanciamento: H+, H2O e OH-. Fonte: Gabriel Bolívar. L'immagine superiore mostra come gli elettroni efficacemente e- Sono collocati come reagenti quando la specie ossidante li vince; E come prodotti quando la specie riducente li perde. Si noti che per bilanciare questo tipo di equazioni è necessario padroneggiare i concetti di ossidazione e numeri di ossidazione.
La specie h+, H2O e oh-, A seconda del pH del mezzo di reazione, consente il bilanciamento redox, quindi è molto comune trovarli negli esercizi. Se il mezzo è acido, ci rivolgiamo a h+; Ma se al contrario il mezzo è di base, allora usiamo l'OH- Per bilanciamento.
La natura della reazione stessa impone quale dovrebbe essere il pH del mezzo. Ecco perché, sebbene possa essere bilanciato assumendo un acido o un mezzo di base, l'equazione bilanciata finale indicherà se gli ioni H sono improbabili o realmente+ e oh-.
[TOC]
Passi
- Generale
Controlla i numeri di ossidazione dei reagenti e dei prodotti
Supponiamo che la seguente equazione chimica:
Cu (s) + agno3(AC) → Cu (no3)2 + AG (S)
Ciò corrisponde a una reazione redox, in cui si verifica un cambiamento nel numero di ossidazione dei reagenti:
Cu0(s) + ag+NO3(AC) → Cu2+(NO3)2 + AG (S)0
Identificare le specie ossidanti e riduttive
La specie ossidante guadagna elettroni ossidando le specie riducenti. Pertanto, il suo numero di ossidazione diminuisce: diventa meno positivo. Nel frattempo, il numero di ossidazione delle specie riducenti aumenta, poiché perde elettroni: diventa più positivo.
Pertanto, nella reazione precedente il rame viene ossidato, poiché passa da Cu0 a cu2+; E l'argento è ridotto, perché va da AG+ Un Ag0. Il rame è la specie riducente e l'argento le specie ossidanti.
Scrivi le semi -reazioni e l'equilibrio atomi e carichi
Identificando quali specie guadagnano o perdono elettroni, sono scritte semi -redox per la reazione di riduzione:
Cu0 → Cu2+
Ag+ → Ag0
Il rame perde due elettroni, mentre l'argento vince uno. Posizioniamo gli elettroni in entrambe le semi -scenari:
Può servirti: fosfato di potassio (K3PO4): struttura, proprietà, usiCu0 → Cu2+ + 2e-
Ag+ + E- → Ag0
Si noti che i carichi rimangono bilanciati in entrambe le semi -reazioni; Ma se fossero stati aggiunti, la legge della conservazione della materia sarebbe violata: il numero di elettroni deve essere lo stesso nelle due semi -reactions. Pertanto, la seconda equazione viene moltiplicata per 2 e vengono aggiunte le due equazioni:
(Cu0 → Cu2+ + 2e-) x 1
(Ag+ + E- → Ag0) x 2
Cu0 + 2ag+ + 2e- → Cu2+ + 2ag0 + 2e-
Gli elettroni vengono annullati per essere ai lati dei reagenti e dei prodotti:
Cu0 + 2ag+ → Cu2+ + 2ag0
Questa è l'equazione ionica globale.
Sostituire i coefficienti dell'equazione ionica nell'equazione generale
Infine, i coefficienti stechiometrici dell'equazione precedente si muovono alla prima equazione:
Cu (s) + 2agno3(AC) → Cu (no3)2 + 2ag (s)
Si noti che il 2 era posizionato con l'agno3 Perché in questo sale l'argento è come AG+, E lo stesso vale per Cu (no3)2. Se questa equazione non è bilanciata alla fine, il punteggio viene effettuato.
L'equazione proposta nelle fasi precedenti avrebbe potuto essere bilanciata direttamente da Tanteo. Tuttavia, ci sono reazioni redox che necessitano di un mezzo acido (h+) o base (oh-) prendere posto. Quando ciò accade, non può essere equilibrato supponendo che il mezzo sia neutro; Come è stato appena visualizzato (non è stato aggiunto o h+ E o oh-).
D'altra parte, è conveniente sapere che le semi -reazioni hanno scritto atomi, ioni o composti (principalmente ossidi) in cui si verificano cambiamenti nei numeri di ossidazione. Questo sarà evidenziato nella sezione degli esercizi.
- Bilanciamento in mezzo acido
Quando il mezzo è acido, devi fermarti alle due semi -reactions. Questa volta al momento dell'equilibrio ignoriamo gli atomi di ossigeno e idrogeno e anche elettroni. Gli elettroni si bilanceranno alla fine.
Quindi, sul lato della reazione con meno atomi di ossigeno, aggiungiamo molecole d'acqua per compensarlo. Dall'altro lato, bilanciamo gli idrogeni con ioni H+. E infine, aggiungiamo gli elettroni e procediamo seguendo i passaggi generali già esposti.
- Bilanciamento nel mezzo di base
Quando il mezzo è di base, è allo stesso modo dell'ambiente acido con una piccola differenza: questa volta sul lato in cui vi sono più ossigeno, verranno posizionate molecole d'acqua pari a questo eccesso di ossigeno; E dall'altra parte, oh ioni- Per compensare gli idrogeni.
Infine, vengono aggiunti l'equilibrio degli elettroni, le due semi -scenari e i coefficienti dell'equazione ionica globale nell'equazione generale vengono sostituiti.
Può servirti: sistemi sparsi: tipi, caratteristiche ed esempiEsempi
Le seguenti equazioni redox senza equilibrio e bilanciate servono come esempi per osservare quanta cambiamento dopo aver applicato questo metodo di bilanciamento:
P4 + Clo- → Po43- + Cl- (senza equilibrio)
P4 + 10 clo- + 6 h2O → 4 PO43- + 10 Cl- + 12 h+ (Mezzo acido equilibrato)
P4 + 10 clo- + 12 Oh- → 4 Po43- + 10 Cl- + 6 h2O (mezzo di base bilanciato)
Yo2 + Kno3 → i- + Kio3 + NO3- (senza equilibrio)
3i2 + Kno3 + 3h2O → 5i- + Kio3 + NO3- + 6h+ (Mezzo acido equilibrato)
Cr2O27- + Hno2 → Cr3+ + NO3- (senza equilibrio)
3hno2 + 5h+ + Cr2O27- → 3no3- +2cr3+ + 4h2O (equilibrio acido equilibrato)
Esercizi
Esercizio 1
Bilancia la seguente equazione nel mezzo di base:
Yo2 + Kno3 → i- + Kio3 + NO3-
Passaggi generali
Iniziamo scrivendo il numero di ossidazione della specie che sospettiamo che abbiano arrugginito o ridotto; In questo caso, atomi di iodio:
Yo20 + Kno3 → i- + Ki5+O3 + NO3-
Si noti che lo iodio si ossida e allo stesso tempo è ridotto, quindi procediamo a scrivere le sue due rispettive semi -reazioni:
Yo2 → i- (Riduzione, per ogni i- 1 elettrone viene consumato)
Yo2 → io3- (Ossidazione, per ogni io3- 5 elettroni vengono rilasciati)
In Ossidation Semi -light posizioniamo l'anione io3-, e non per l'atomo di iodio come me5+. Bilanciamo gli atomi di iodio:
Yo2 → 2i-
Yo2 → 23-
Bilanciamento nel mezzo di base
Ora ci concentriamo sullo oscillazione in mezzo base la semi -reazione dell'ossidazione, poiché ha una specie ossigenata. Aggiungiamo il lato dei prodotti lo stesso numero di molecole d'acqua come gli atomi di ossigeno:
Yo2 → 23- + 6h2O
E sul lato sinistro bilanciamo gli idrogeni con oh-:
Yo2 + 12oh- → 23- + 6h2O
Scriviamo le due semi -reazioni e aggiungiamo gli elettroni mancanti per bilanciare i carichi negativi:
Yo2 + 2e- → 2i-
Yo2 + 12oh- → 23- + 6h2O + 10e-
Abbiamo abbinato entrambi i numeri di elettroni in entrambe le semi -scenari e aggiungendoli:
(Yo2 + 2e- → 2i-) x 10
(Yo2 + 12oh- → 23- + 6h2O + 10e-) x 2
12i2 + 24 Oh- + 20E- → 20i- + 4 °3- + 12h2O + 20E-
Gli elettroni vengono annullati e divisi tutti i coefficienti da quattro per semplificare l'equazione ionica globale:
(12i2 + 24 Oh- → 20i- + 4 °3- + 12h2O) x ¼
3i2 + 6oh- → 5i- + Io3- + 3h2O
E infine, sostituiamo i coefficienti dell'equazione ionica nella prima equazione:
3i2 + 6oh- + Kno3 → 5i- + Kio3 + NO3- + 3h2O
Può servirti: forza ionica: unità, come calcolarlo, esempiL'equazione è già bilanciata. Confronta questo risultato con il bilanciamento in un mezzo acido di esempio 2.
Esercizio 2
Equilibra la seguente equazione in mezzo acido:
Fede2O3 + CO → Fe + Co2
Passaggi generali
Osserviamo il numero di ossidazione di ferro e carbonio per sapere quale dei due ha ossidato o ridotto:
Fede23+O3 + C2+O → Faith0 + C4+O2
Il ferro è stato ridotto, quindi è la specie ossidante. Nel frattempo, il carbonio ha arrugginito, comportandosi come le specie riducenti. Le semi -reazioni per l'ossidazione e il ridotto riguardanti sono:
Fede23+O3 → Fede0 (riduzione, per ogni fede 3 elettroni vengono consumati)
CO → CO2 (Ossidazione, per ogni CO2 2 elettroni vengono rilasciati)
Nota che scriviamo l'ossido, la fede2O3, Perché contiene fede3+, Invece di mettere la fede3+. Bilanciamo gli atomi necessari tranne l'ossigeno:
Fede2O3 → 2fe
CO → CO2
E il bilanciamento viene effettuato nell'acido in entrambe le semi -reazioni, poiché ci sono specie ossigenate in mezzo.
Bilanciamento in mezzo acido
Aggiungiamo acqua per bilanciare l'ossigeno, quindi H+ Per bilanciare gli idrogeni:
Fede2O3 → 2fe + 3h2O
6h+ + Fede2O3 → 2fe + 3h2O
CO + H2O → CO2
CO + H2O → CO2 + 2h+
Ora bilanciamo i carichi posizionando gli elettroni coinvolti nelle semi -reazioni:
6h+ + 6e- + Fede2O3 → 2fe + 3h2O
CO + H2O → CO2 + 2h+ + 2e-
Abbiniamo il numero di elettroni in entrambe le semi -scenari e li aggiungiamo:
(6h+ + 6e- + Fede2O3 → 2fe + 3h2O) x 2
(CO + H2O → CO2 + 2h+ + 2e-) x 6
12 h+ + 12e- + 2fe2O3 + 6co + 6h2O → 4fe + 6h2O + 6co2 + 12h+ + 12e-
Annulliamo elettroni, ioni H+ E le molecole d'acqua:
2fe2O3 + 6co → 4fe +6co2
Ma questi coefficienti possono essere divisi per due per semplificare ancora di più l'equazione, avendo:
Fede2O3 + 3co → 2fe +3co2
Questa domanda sorge: era necessario un bilanciamento redox per questa equazione? Di Tanteo sarebbe stato molto più veloce. Ciò dimostra che questa reazione procede in modo intercambiabile dal pH medio.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Helmestine, Anne Marie, PH.D. (22 settembre 2019). Come bilanciare le reazioni redox. Recuperato da: Thoughtco.com
- Ann Nguyen e Brar Luvleen. (5 giugno 2019). Bilanciamento delle reazioni redox. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Quimitube. (2012). Esercizio 19: aggiustamento di una reazione redox in mezzo base con due semi di ossidazione. Recuperato da: quimitube.com
- Washington University in ST. Louis. (S.F.). Problemi di pratica: reazioni redox. Recuperato da: chimica.Wustl.Edu
- John Wiley & Sons. (2020). Come bilanciare le equazioni redox. Recuperato da: Dummies.com
- Rubén Darío o. G. (2015). Bilanciamento delle equazioni chimiche. Recuperato da: impara in linea.Voi.Edu.co
- « Disuguaglianza e movimenti sociali in Messico (1950-1980)
- Metodo MOHR Fondamenti, reazioni, procedura, usi »

