Metodo di bilanciamento algebrico (con esempi)

- 885
- 47
- Enzo De Angelis
Lui Metodo di equilibrio algebrico È usato in chimica per abbinare il numero di atomi su entrambi i lati di una reazione chimica. Una reazione chimica scritta correttamente, deve avere le formule di tutti i reagenti che partecipano sul lato sinistro e i prodotti, anche con le loro formule, sul lato destro.
Tuttavia, quando si ha una reazione, il numero di atomi nelle formule dei reagenti è uguale a quello dei rispettivi atomi nelle formule dei prodotti non sempre non sempre.
 Figura 1. Il metodo di bilanciamento algebrico è uno strumento semplice per bilanciare le equazioni chimiche. Fonte: f. Zapata.
Figura 1. Il metodo di bilanciamento algebrico è uno strumento semplice per bilanciare le equazioni chimiche. Fonte: f. Zapata. Tuttavia, l'impasto viene preservato. Ad esempio, vediamo la seguente reazione:
Kcl3 → Kcl + O2
Questa equazione ha un composto chiamato clorato di potassio, che è scomposto riscaldando in cloruro di potassio e ossigeno a gas. Ma quando guardiamo attentamente, notiamo che nella molecola di clorato ci sono 3 atomi di ossigeno, mentre a destra c'è solo una molecola di ossigeno a gas con 2 atomi.
Ciò che viene quindi fatto è moltiplicare per un coefficiente numerico al reagente della sinistra, in modo che il numero di atomi di tutti gli elementi partecipanti sia lo stesso prima e dopo la reazione.
Ma ... qual è il valore di questo coefficiente?
[TOC]
Modi per bilanciare le equazioni
Nell'equazione precedente è facile determinare i coefficienti appropriati mediante ispezione. Se moltiplichiamo per 2 a sinistra abbiamo 2 atomi di K, 2 di Cl e 6 di O.
Pertanto, a destra moltiplichiamo il cloruro di potassio per 2 e la O2 di 3:
2 KCLO3 → 2kcl + 3o2
E ora possiamo vedere che la contabilità è corretta su entrambi i lati della freccia e la reazione è stata bilanciata. Si noti che altri valori numerici possono anche comportare un'equazione bilanciata, ad esempio:
Può servirti: acido borico: struttura chimica, proprietà, preparazione, usi4 KCLO3 → 4kcl + 6o2
Tuttavia, l'insieme di numeri minimi interi che equivalgono alla quantità di atomi su entrambi i lati dovrebbe essere sempre richiesto.
I numeri che moltiplicano ogni formula sono chiamati coefficienti. È molto importante notare che i coefficienti possono essere assegnati a bilanciamento, ma gli abbonamenti devono rimanere come appaiono in ogni formula.
Né i coefficienti possono essere inseriti nel mezzo della formula di ciascun composto, poiché lo modificherebbe.
Equazioni semplici come l'esempio possono essere bilanciate dall'ispezione o dal punteggio. Per coloro che sono un po 'più complessi c'è un metodo algebrico con una serie di semplici passaggi e operazioni aritmetiche elementari dettagliate di seguito.
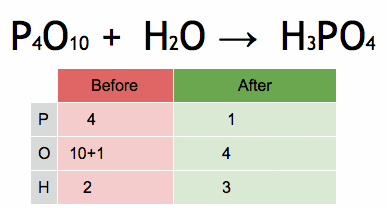 figura 2. Animazione che mostra il bilanciamento di un'equazione chimica per ottenere acido fosforico. Fonte: Wikimedia Commons. EPhert/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)
figura 2. Animazione che mostra il bilanciamento di un'equazione chimica per ottenere acido fosforico. Fonte: Wikimedia Commons. EPhert/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0) Passaggi per bilanciare algebricamente un'equazione chimica
Passo 1
-Assegnare a ciascuna molecola un coefficiente arbitrario, simboleggiato da una lettera. Testi A, B, C, D .. ., Se necessario, se necessario.
Importante: Ricordiamo che solo un coefficiente viene utilizzato dalla molecola e non viene mai intervallato nel mezzo, è sempre posizionato a sinistra.
Passo 2
-Fai un elenco di ogni elemento partecipante.
Passaggio 3
-Posizionare il coefficiente o i coefficienti assegnati a ciascun composto a sinistra e abbinare quelli a destra. Se ci sono abbonamenti, si moltiplicano per il coefficiente per trovare il numero totale di atomi.
E se si trova un elemento in più di una molecola, vengono aggiunte le quantità di atomi presenti su ciascun lato. In questo modo il equazioni parziali di ogni elemento.
Passaggio 4
-Un valore numerico è assegnato a uno dei coefficienti. Di solito questo valore numerico è 1 ed è assegnato alla lettera che appare più volte. Ciò raggiunge una semplice equazione che funge da punto di partenza per trovare gli altri coefficienti.
Può servirti: fattore di diluizionePassaggio 5
-Determinare il valore del seguente coefficiente mediante semplice aritmetica e sostituire il suo valore in un'altra equazione, per aumentare un nuovo.
Passaggio 6
-Ripeti il passaggio precedente per sostituire i valori e creare una nuova equazione, fino a trovare tutti i coefficienti.
Passaggio 7
-Sostituire i valori così determinati. Se questi valori sono interi, deve essere verificato che l'equazione era bilanciata. Se non erano interi, viene moltiplicato per il multiplo comune minimo dei denominatori e il saldo viene verificato.
Quindi visualizzeremo l'applicazione di questi passaggi nella risoluzione di alcuni esempi.
Esempi di bilanciamento risolti
Esempio 1
Bilancia la seguente reazione, se necessario, attraverso il metodo algebrico:
N2O5 → n2O4 + O2
Soluzione
Osserviamo che la reazione non è bilanciata, perché sebbene ci siano 2 atomi di azoto su entrambi i lati, con ossigeno le quantità a sinistra e a destra sono diverse.
Quindi dobbiamo seguire i passaggi descritti nella sezione precedente:
-Scriviamo di nuovo l'equazione e moltiplichiamo ogni molecola per un coefficiente diverso. Le lettere minuscole vengono scelte in modo che non siano confuse con gli elementi:
A⋅n2O5 → B⋅n2O4 + C⋅o2
-Ora elenchiamo ogni elemento e abbiniamo gli importi di quell'elemento a sinistra e a destra. Queste sono le equazioni parziali per ciascun elemento:
- A⋅n2 = B⋅n2
- A⋅o5 = B⋅o4 + C⋅o2
-Moltiplicando il coefficiente e il pedice otteniamo il numero di atomi di azoto. Dall'equazione 1 otteniamo:
2a = 2b
-Di equazione 2 hanno 5 ° atomi di ossigeno a sinistra, mentre a destra ci sono 4b E 2 c:
5a = 4b + 2c
-Assediamo il valore 1 al coefficiente a, in questo modo:
A = 1
Questa scelta è arbitraria, potrebbe anche essere scelto per primo b = 1.
-Questi valori vengono sostituiti nell'equazione 2, per determinare il valore di C:
Può servirti: ossido cupric (CUO)5 = 4 + 2c
2c = 5-4 = 1
C = ½
-Sostituiamo i coefficienti nell'equazione originale, l'1 non è necessario per scriverlo esplicitamente:
N2O5 → n2O4 + ½ o2
-Poiché è preferibile che i coefficienti siano interi, l'intera equazione viene moltiplicata per il multiplo comune minimo dei denominatori, che sono 2 e 1:
M.C.M. (1.2) = 2
Quindi, moltiplicando a sinistra e a destra per 2, si ottiene:
2n2O5 → 2n2O4 + O2
E contiamo il numero di atomi su entrambi i lati, per controllare il saldo:
- N A sinistra: 4
- O a sinistra: 10
- N A destra: 4
- O a destra: 8 + 2 = 10
Esempio 2
Equilibra la seguente reazione chimica:
Nahco3 → Na2Co3 + H2O + co2
Soluzione
Moltiplichiamo ogni molecola per un coefficiente diverso:
A⋅ nahco3 → B⋅na2Co3 + C⋅h2O + d⋅co2
Quindi proponiamo la contabilità di ciascun elemento a destra e a sinistra della freccia. Ci sono un totale di 4 elementi nella reazione: sodio NA; Idrogeno H; auto e ossigeno o, tutto deve essere conteggiato:
- A⋅na = b⋅na2
- a⋅h = c⋅h2
- A⋅c = b⋅c + d⋅c
- A⋅o3 = B⋅o3+C⋅o+d⋅o2
Secondo ogni saldo, si ottengono le seguenti equazioni:
1) a = 2b
2) a = 2c
3) A = B + D
4) a = 3b + c + 2d
Il coefficiente più ripetuto è A, Pertanto assegniamo il valore 1:
A = 1
COSÌ:
1) a = 2b ⇒ b = ½
2) a = 2c ⇒ c = ½
3) a = b + d ⇒ d = a - b = 1 - ½ = ½
Sostituiamo i coefficienti nell'equazione:
Nahco3 → ½. N / a2Co3 + ½. H2O + ½.Co2
Moltiplichiamo su entrambi i lati della freccia per 2, poiché è l'unico denominatore presente, per eliminare la frazione:
2nahco3 → Na2Co3 + H2O + co2
Contiamo il numero di atomi presenti a sinistra: 2 atomi di Na, H e C e 6 di O. Il lettore può verificare che ciascuno di essi sia presente a destra nelle stesse quantità.
Riferimenti
- Atkins, p. Principi di chimica: i percorsi della scoperta. Pan -American Medical Editoriale. 3a edizione.
- Briceño, J. Guida di chimica USB. Recuperato da: Gecousb.com.andare.
- Chang, R. 2013. Chimica. 11va. Edizione. Mc Graw Hill Education.
- Esercizi risolti. Bilanciamento algebrico. Estratto da: esercitazioni SULET.co.
- Simoza, l. Bilanciamento delle equazioni chimiche. Recuperato da: guao.org.
- « Caratteristiche dei cariche morti, calcolo, esempi
- Funzionalità di architettura Inca e costruzioni eccezionali »

