Modello atomico di Schrödinger

- 2086
- 2
- Zelida Gatti
Qual è il modello atomico di Schrödinger?
Lui Modello atomico di Schrödinger È una proposta per l'operazione e la struttura dell'atomo sviluppato da Erwin Schrödinger nel 1926. È noto come il modello meccanico quantico dell'atomo e descrive il comportamento d'onda dell'elettrone.
Per questo, l'eccezionale fisico austriaco si basava sull'ipotesi di Broglie, che affermava che ogni particella in movimento è associata a un'onda e può comportarsi come tale.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger ha suggerito che il movimento degli elettroni nell'atomo corrispondeva alla dualità delle particelle d'onda e, di conseguenza, gli elettroni potevano mobilitarsi attorno al nucleo come onde fisse.
Schrödinger, a cui è stato assegnato il premio Nobel nel 1933 per i suoi contributi alla teoria atomica, ha sviluppato l'equazione omonima per calcolare la probabilità che un elettrone si trovi in una posizione specifica.
Caratteristiche del modello atomico di Schrödinger
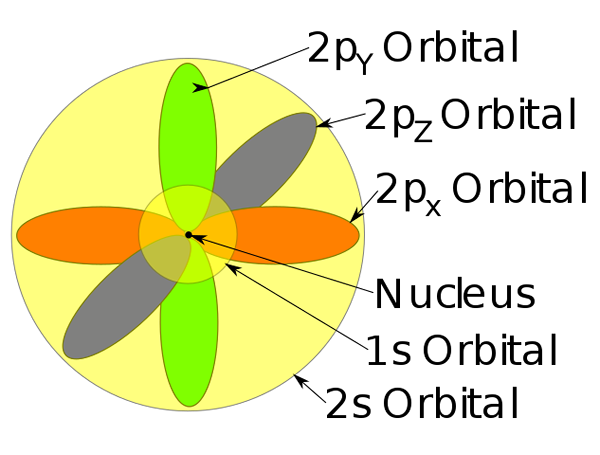 Orbitali 1s, 2s e 2p all'interno di un atomo di sodio.
Orbitali 1s, 2s e 2p all'interno di un atomo di sodio. -Questo modello atomo descrive il movimento degli elettroni come onde stazionarie.
-Gli elettroni si muovono costantemente, cioè non hanno una posizione fissa o definita all'interno dell'atomo.
-Questo modello non prevede la posizione dell'elettrone, né descrive il percorso che fa all'interno dell'atomo. Stabilisce solo una zona di probabilità per individuare l'elettrone.
-Queste aree di probabilità sono chiamate orbitali atomiche. Gli orbitali descrivono un movimento di traduzione attorno al nucleo dell'atomo.
-Questi orbitali atomici hanno livelli diversi e sotto -livelli di energia e possono essere definiti tra le nuvole di elettroni.
-Il modello non contempla la stabilità del nucleo, si riferisce solo a spiegare i meccanici quantistici associati al movimento degli elettroni all'interno dell'atomo.
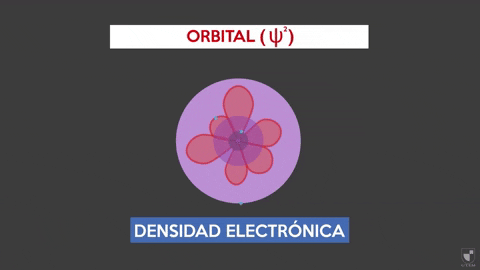 La densità elettronica indica la probabilità di trovare un elettrone vicino al nucleo. Più vicino al nucleo (zona viola) ci sarà più probabilità, mentre sarà inferiore se ti allontani dal nucleo (area viola).
La densità elettronica indica la probabilità di trovare un elettrone vicino al nucleo. Più vicino al nucleo (zona viola) ci sarà più probabilità, mentre sarà inferiore se ti allontani dal nucleo (area viola). Sperimentare
Il modello atomico di Schrödinger si basa sull'ipotesi di Broglie, nonché sui precedenti modelli atomici di Bohr e Sommerfeld.
Può servirti: attrito dinamico o cinetico: coefficiente, esempi, eserciziBroglie ha proposto che proprio come le onde hanno particelle, le particelle hanno proprietà d'onda, con una lunghezza d'onda associata. Qualcosa che ha generato molte aspettative in quel momento, essendo Albert Einstein stesso alla sua teoria.
Tuttavia, la teoria di Broglie aveva una mancanza, che era che il significato della propria idea non era compreso molto bene: un elettrone può essere un'onda, ma che dire di cosa? Questo è quando la figura di Schrödinger sembra rispondere.
Per fare ciò, il fisico austriaco ha fatto affidamento sull'esperimento di Young e, basato sulle sue osservazioni, ha sviluppato l'espressione matematica che porta il suo nome.
Successivamente le basi scientifiche di questo modello atomico:
Esperimento di Young: la prima dimostrazione di dualità da particella d'onda
L'ipotesi di Broglie sulla natura ondulata e corpuscolare del soggetto può essere dimostrata dall'esperimento di Young, noto anche come esperimento a doppia fessura.
Lo scienziato inglese Thomas Young ha gettato le basi del modello atomico di Schrödinger quando nel 1801 ha condotto l'esperimento per verificare la natura ondulata della luce.
Durante la sua sperimentazione, Young ha diviso l'emissione di un raggio di luce che attraversa un piccolo foro attraverso una camera di osservazione. Questa divisione si ottiene utilizzando una scheda da 0,2 millimetri, situata parallela al raggio.
Il design dell'esperimento è stato realizzato affinché il raggio di luce fosse più ampio della carta, posizionando così la scheda in orizzontale, il raggio è stato diviso in approssimativamente le stesse parti. L'uscita delle travi di luce era diretta da uno specchio.
Può servirti: forze di distanzaEntrambe le travi di luce colpiscono un muro in una stanza buia. Lì è stato evidenziato il modello di interferenza tra le due onde, che è stato dimostrato che la luce poteva comportarsi tanto quanto una particella e un'onda.

Un secolo dopo, Albert Einsten ha rafforzato l'idea attraverso i principi della meccanica quantistica.
L'equazione di Schrödinger
Schrödinger ha sviluppato due modelli matematici, differenziando ciò che accade a seconda che lo stato quantico cambi nel tempo o no.
Per l'analisi atomica, Schrödinger pubblicò alla fine del 1926.
Ciò implica che l'onda non si muove, i suoi nodi, cioè i suoi punti di equilibrio, fungono da perno per il resto della struttura per muoversi attorno a loro, descrivendo una certa frequenza e ampiezza.
Schrödinger ha definito le onde che descrivono gli elettroni come stati stazionari o orbitali e sono associati, a loro volta, a diversi livelli di energia.
L'equazione temporale indipendente di Schrödinger è la seguente:
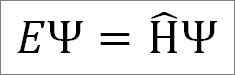
Dove:
E: Costante di proporzionalità.
Ψ: Funzione d'onda del sistema quantico.
Η ̂: Operatore hamiltoniano.
L'equazione temporale indipendente di Schrödinger viene utilizzata quando l'osservabile che rappresenta l'energia totale del sistema, nota come operatore hamiltoniano, non dipende dal tempo. Tuttavia, la funzione che descrive al movimento totale dell'onda dipenderà sempre dal tempo.
L'equazione di Schrödinger indica che se hai una funzione d'onda ψ e l'operatore hamiltoniano agisce su di essa, la costante di proporzionalità e rappresenta l'energia totale del sistema quantico in uno dei suoi stati stazionari.
Può servirti: variabile discreta: caratteristiche ed esempiApplicato al modello atomico di Schrödinger, se l'elettrone si muove in uno spazio definito, vi sono valori di energia discreti e se l'elettrone è spostato liberamente nello spazio, si verificano intervalli di energia continui.
Dal punto di vista matematico, esistono diverse soluzioni per l'equazione di Schrödinger, ogni soluzione implica un valore diverso per la costante di proporzionalità e.
Secondo il principio di incertezza di Heisenberg, non è possibile stimare la posizione o l'energia di un elettrone. Di conseguenza, gli scienziati riconoscono che la stima della posizione dell'elettrone all'interno dell'atomo è inaccurata.
Postulati del modello atomico di Schrödinger
I postulati del modello atomico di Schrödinger sono i seguenti:
-Gli elettroni si comportano come onde stazionarie distribuite nello spazio secondo la funzione d'onda ψ.
-Gli elettroni si muovono all'interno dell'atomo che descrivono gli orbitali. Queste sono aree in cui la probabilità di trovare un elettrone è considerevolmente più alta. La probabilità di cui sopra è proporzionale al quadrato della funzione d'onda ψ2.
La configurazione elettronica del modello atomico Schrödinguer spiega le proprietà periodiche di atomi e collegamenti che si formano.
Tuttavia, il modello atomico di Schrödinger non contempla la rotazione degli elettroni e non considera le variazioni di elettroni veloci a causa di effetti relativistici dovuti agli effetti relativistici.
Articoli di interesse
Broglie Atomic Model.
Modello atomico di Chadwick.
Modello atomico Heisenberg.
Modello atomico Perrin.
Modello atomico Thomson.
Modello atomico Dalton.
Modello atomico di Dirac Jordan.
Modello atomico di Democrito.
Modello atomico Leucipo.
Modello atomico Bohr.
Modello atomico Sommerfeld.
Modello atomico attuale.
Riferimenti
- Il modello meccanico quantico dell'atomo recuperato: è.Khan Academy.org
- L'equazione delle onde di Schrödinger.F.). Jaime I University. Castellón, Spagna. Recuperato da: uji.È
- Teoria atomica moderna: modelli. © Abcte. Recuperato da: Abcte.org
- La mod atomica di Schrodinger.F.). Recuperato da: Erwinschrodingerbiography.Weebly.com
- Wikipedia, Enciclopedia gratuita. Equazione di Schrödinger. Recuperato da: è.Wikipedia.org
- Wikipedia, Enciclopedia gratuita. Giovane esperimento. Recuperato da: è.Wikipedia.org

