Legge di molteplici proporzioni
- 2546
- 774
- Lidia Valentini
Qual è la legge di più proporzioni?
IL Legge di molteplici proporzioni Stabilisce che se due elementi formano più di un composto quando reagiscono tra loro, allora la proporzione delle masse con cui una di esse è combinata con una massa fissa dell'altro, è uguale a una relazione di piccoli numeri.
La dichiarazione della legge può sembrare complessa se non si ha un esempio. Considera quindi alcuni biscotti Oreos, composti da due coperchi al cioccolato e una striscia di crema zuccherata: T2C (t = coperchio e c = crema). Se volessimo inventare un biscotto Oreo più robusto, aggiungeremmo un'altra striscia di crema, per avere una doppia crema (t2C2 o TC).
 Nei dessert, come i cookie Oreos, abbiamo proporzioni che possono essere variate semplicemente per prepararne altre versioni. Fonte: Brokensphere, CC BY-SA 3.0 https: // creativeCommons.Org/licenze/by-sa/3.0 via Wikimedia Commons
Nei dessert, come i cookie Oreos, abbiamo proporzioni che possono essere variate semplicemente per prepararne altre versioni. Fonte: Brokensphere, CC BY-SA 3.0 https: // creativeCommons.Org/licenze/by-sa/3.0 via Wikimedia Commons Potremmo anche aggiungerne un altro, in modo che il biscotto abbia tre volte più crema di un biscotto convenzionale (T2C3). E se mettessimo un altro coperchio di cioccolato nel mezzo delle strisce bianche (t3C2)? Le opzioni sono illimitate; Ma aggiungiamo sempre un coperchio o un'unità crema. Non pensiamo a metà del coperchio (1/2 t) o un quinto di crema (1/5 c), perché sarebbe inappropriato.
Allo stesso modo accade con gli elementi chimici: i loro atomi non si dividono per formare composti. Pertanto, le masse di T o C tra i loro composti "sempre" una relazione semplice.
Spiegazione
Proporzioni
La legge di molteplici proporzioni, insieme alla legge delle proporzioni definite, ha preceduto la stechiometria e le prime formule chimiche. Dimentichiamo i biscotti, ma manteniamo i loro simboli: t e c. Attraverso esperimenti, si scopre che gli elementi T e C formano diversi composti: T2C, TC e T2C3.
Prima delle formule chimiche era impossibile sapere subito quali erano le proporzioni delle masse di T e C in tali composti. Ho dovuto prima determinarli. In un composto, è stato scoperto che la massa di T raddoppiava a quella di C; Per dire, 2 grammi di t sono combinati con 1 grammo di c.
Può servirti: capacità: unità, formule, calcolo, esempiQuindi, nell'altro composto, le masse di T e C dovevano essere abbinate: 2 grammi di T sono ora combinati con 2 grammi di C. Qui sorge la domanda: cosa succede se T e C possono ancora formare un altro composto? In tal caso, sarebbe sicuramente formato con 2 grammi di T, ma questa volta sarebbero combinati con 3 grammi di C (1 grammo + 1 grammo + 1 grammo).
Semplici relazioni di massa
Le proporzioni delle masse con cui T e C reagiscono consentono di stabilire le loro formule chimiche: T2C (2 grammi T: 1 grammo C), TC (2 grammi T: 2 grammi C) e T2C3 (2 grammi T: 3 grammi C). Se vogliamo confrontare le relazioni delle masse T o C in questi composti, è necessario che una delle sue masse rimanga costante; In questo caso quello di t: 2 grammi.
Pertanto, determineremo le proporzioni di massa di C in questi tre composti:
- T2C: 1 grammo c/2 grammi t
- TC: 2 grammi c/2 grammi t
- T2C3: 3 grammi c/2 grammi t
Avremo una relazione per la massa di C pari a 1: 2: 3. Cioè, ci sono 2 volte più C in TC che in t2C e 3 volte più c in t2C3 che in t2C. Come si può vedere, 1: 2: 3 sono piccoli numeri interi (non superano nemmeno la dozzina).
Esempi della legge di molteplici proporzioni
Per i seguenti esempi, verranno applicati gli stessi passaggi precedenti, ma prenderemo in considerazione le masse molari dei rispettivi elementi, assumendo una mole del composto.
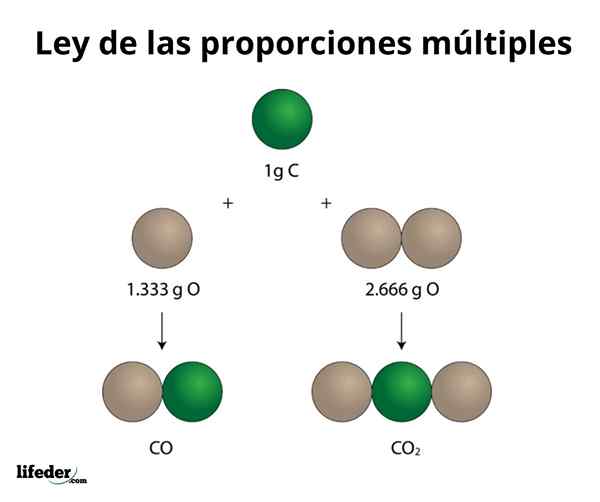
NOCE DI COCCO2

Questo esempio spiega in modo semplice come funziona la legge di più proporzioni; Nel CO (monossido di carbonio), ci sono 1.333 grammi di ossigeno per ogni grammo di carbonio. Nell'anidride carbonica (CO₂), ce ne sono 2.666 grammi di ossigeno per ogni grammo di carbonio. Pertanto, la proporzione di ossigeno in entrambi i composti è 1: 2, un piccolo numero intero.
H2OH2O2
La legge multipla delle proporzioni si applica alla coppia di H2OH2O2.
Può servirti: 30 esempi di sospensioni chimicheIn una mol di h2Oppure, 2 grammi di idrogeno sono combinati con 16 grammi di ossigeno. Nel frattempo, in una mol di H2O2, 2 grammi di idrogeno sono combinati con 32 grammi di ossigeno. Per verificare se questa legge è soddisfatta, dobbiamo impostare la stessa massa per uno degli elementi in entrambi i composti. Questa volta è idrogeno: 2 grammi.
Proporzioni di massa per h2O e h2O2 Sono:
- H2O: 16 grammi o/2 grammi H
- H2O2: 32 grammi o/2 grammi H
Il rapporto tra la massa di O sarà 16:32. Tuttavia, possiamo semplificarlo dividendo per 16, rimanendo 1: 2. Ancora una volta, la relazione finale è composta da piccoli numeri interi.
SW2-SW3
In un mole di così2, 32 grammi di zolfo sono combinati con 32 grammi di ossigeno. Nel frattempo, in un mole di SO3, 32 grammi di zolfo sono combinati con 48 grammi di ossigeno. La massa di zolfo è la stessa per entrambi i composti, quindi possiamo confrontare direttamente le proporzioni di ossigeno:
- SW2: 32 grammi o
- SW3: 48 grammi o
Essere il rapporto tra la massa di ossigeno tra i due composti pari a 32:48 o 1: 1.5. Ma non c'erano che ci fossero numeri interi? Relazione 1: 1.5 (1/1.5) Può anche essere scritto come 2: 3 (0.6), e di nuovo avremo piccoli numeri interi: 2 e 3.
Si noti che avremmo potuto anche scrivere la relazione come 48:32 o 1.5: 1, essendo il risultato 3: 2. La legge non cambia, solo l'interpretazione della relazione: c'è 1.5 o 3/2 volte più ossigeno nel SO3 Quello nel SO2; che è lo stesso per dire che ci sono 2/3 o 0.6 volte meno ossigeno nel SO2 Quello nel SO3.
No no2-N2SU2O3-N2O5
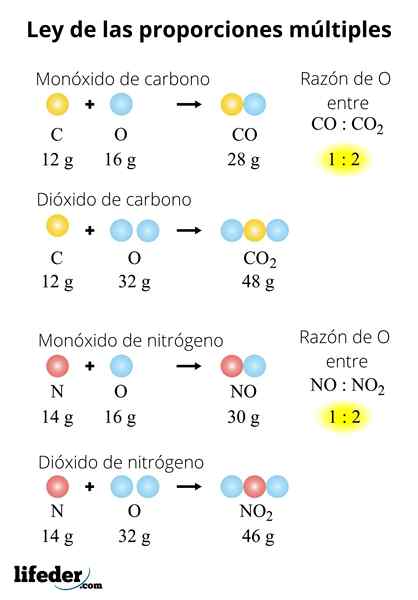
La legge può anche essere applicata per una serie di composti. Considera gli ossidi di azoto: not-not2-N2SU2O3-N2O5. Per valutare questa legge in essi dobbiamo impostare una massa di azoto: 28 grammi. Perché? Perché no e no2 Hanno un atomo di azoto inferiore agli altri ossidi:
- 2 (no): 28 grammi N/32 grammi o
- 2 (n2): 28 grammi N/64 grammi o
- N2O: 28 grammi N/ 16 grammi o
- N2O3: 28 grammi N/ 48 grammi o
- N2O5: 28 grammi N/ 80 grammi o
Dimentichiamo l'azoto e ci concentriamo sui grammi dell'ossigeno:
- 2 (no): 32 grammi o
- 2 (n2): 64 grammi o
- N2O: 16 grammi o
- N2O3: 48 grammi o
- N2O5: 80 grammi o
Essere il rapporto tra masse di o uguale a 32: 64: 16: 48: 80. Per semplificarlo, dividiamo tutti i suoi numeri tra i più piccoli, il 16, essendo come 2: 4: 1: 3: 5.
Cioè, ci sono: 2 volte più ossigeno nel NO che nella N2O, 4 volte più ossigeno nel no2 quello nell'in N2Oppure, 3 volte più ossigeno nella n2O3 quello nell'in N2Oppure, e 5 volte più ossigeno nella n2O5 quello nell'in N2O. Ancora una volta, abbiamo piccoli numeri interi, che vanno da 1 a 5.
Limitazioni
La legge di più proporzioni non è sempre soddisfatta. Ad esempio, le masse molari o i pesi atomici degli elementi non sono figure intere, ma ha molti decimali. Ciò modifica completamente le relazioni calcolate, che cessano di essere semplici.
Allo stesso modo, la legge non è soddisfatta per composti pesanti, come alcuni idrocarburi. Ad esempio, l'Undecano, CundiciH24, ha 1.0083 o 121/120 volte più idrogeno del decano, C10H22, la cui relazione è composta da 121 e 120, che superano la dozzina; Non sono piccoli numeri interi.
E infine, la legge fallisce con i composti non sistoichiometrici, come con molti ossidi e solfuri.
Conclusione
La legge delle proporzioni multiple afferma che quando due elementi formano più di un composto, le diverse masse di un elemento che si combinano con la stessa massa dell'altro elemento sono in proporzione a un piccolo numero.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2020). Legge di molteplici proporzioni. Recuperato da: in.Wikipedia.org
- I redattori di Enyclopedia Britannica. (2020). Legge di molteplici proporzioni. Recuperato da: Britannica.com
- Chimica. (4 giugno 2019). Legge delle proporzioni multiple di Dalton. Recuperato da: Chemistrygod.com
- Garcia Nissa. (2020). Legge di più proporzioni: definizione ed esempio. Studio. Recuperato da: studio.com

