La legge di Henry

- 4041
- 600
- Kayla Serr
 La legge di Henry spiega l'effervescenza delle bevande analcoliche
La legge di Henry spiega l'effervescenza delle bevande analcoliche Qual è la legge di Henry?
IL La legge di Henry È la relazione che descrive l'effetto della pressione sulla solubilità del gas. Questa legge stabilisce che la solubilità di un gas in contatto con la superficie di un liquido a una data temperatura è direttamente proporzionale alla pressione parziale di detto gas sul liquido.
Ciò significa che, maggiore è la pressione del gas su un liquido, maggiore è la quantità totale di gas che può essere sciolta in esso, ottenendo così una maggiore concentrazione (cioè maggiore è la solubilità).
La legge di Henry lo vediamo in azione ogni volta che scopriamo una bevanda di soda. Essere chiusi, l'alta pressione all'interno della bottiglia mantiene il gas carbonico sciolto. Ma scoprendolo, la pressione del gas diminuisce, il che riduce la sua solubilità e sfugge alla formazione di bolle e effervescenza.
Formula legale di Henry
In forma matematica, la legge di Henry è espressa come una legge di proporzionalità:
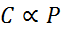
Questa legge di proporzionalità si trasforma in:
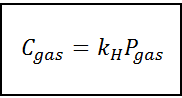
Dove C Si riferisce alla massima concentrazione di gas nel liquido, cioè alla sua solubilità; Pgas È la pressione parziale del gas in contatto con il liquido e KH È una costante di proporzionalità chiamata Costante la legge di Henry.
La concentrazione di gas può essere espressa in diverse unità come molarità, moleità o frazione molare. Tuttavia, nella maggior parte dei casi, i prodotti chimici usano la concentrazione nelle unità di molarità (in mol/L), mentre la pressione è espressa in atmosfere.
Può servirti: antracene: cosa è, struttura, proprietà, usiLa costante della legge di Henry (KH)
Il costante KH Descrivi le interazioni tra un gas e un solvente. Più forti sono queste interazioni, maggiore è la costante e, quindi, maggiore è la solubilità del gas nel solvente a una certa temperatura e pressione.
Numericamente, il valore di KH rappresenta la solubilità del gas alla temperatura data, quando la pressione parziale della stessa è 1 atm.
A seconda delle unità di concentrazione e pressione utilizzate nell'equazione, questa costante può avere unità mol/L.ATM, mol/kg.ATM, ecc.
La tabella seguente mostra i valori della costante della legge di Henry per alcuni gas comuni in acqua a 25 ° C:

Questi valori diminuiscono con la temperatura, poiché la solubilità dei gas in generale diminuisce a una temperatura più elevata.
Spiegazione della legge di Henry
La legge di Henry è molto facile da capire dal punto di vista microscopico. Possiamo immaginare un gas come una serie di particelle molto piccole che rimbalzano su tutte le superfici che giocano. Quando si scontrano con la superficie di un liquido, alcune particelle rimbalzeranno, mentre altre attraverseranno la superficie intrappolata (cioè, si dissolveranno).
Lo stesso vale per le particelle di gas che vengono sciolte. Rimbalzano con le pareti del contenitore e possono anche raggiungere la superficie del liquido, dove alcuni rimbalzeraranno mentre altri attraversano la superficie e sfuggono alla fase gassosa.
Quando viene raggiunto l'equilibrio, le velocità con cui il gas si dissolve nel solvente e con cui li sfugge sono uguali, quindi la concentrazione rimane costante.
Può servirti: proprietà meccaniche dei metalli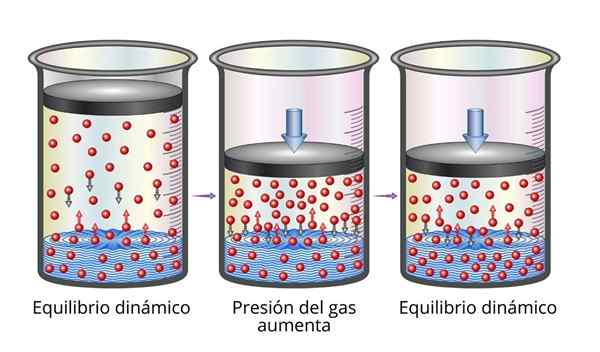 Spiegazione della legge di Henry
Spiegazione della legge di Henry Quando aumentiamo la pressione del gas, quello che stiamo facendo è aumentare la frequenza con cui le particelle di gas si scontrano con la superficie del liquido. Questo fa la velocità con cui aumenta il gas. Quando viene raggiunta una nuova bilancia, la nuova concentrazione di gas sarà maggiore.
Eccezioni alla legge di Henry
È importante sottolineare che la legge di Henry è una legge ideale, che descrive solo il comportamento delle soluzioni di gas reali a determinate condizioni. Pertanto, la legge di Henry può essere applicata solo quando:
- La temperatura rimane costante.
- Il gas è in equilibrio con la soluzione.
- La pressione del gas è relativamente bassa.
- Il gas non reagisce con il solvente.
Nonostante ciò, anche in alcuni casi in cui il gas reagisce con il solvente, questa legge può essere applicata approssimativamente.
Esempi di applicazione della legge di Henry
Esempio 1: determinazione della costante della legge di Henry
È stato determinato sperimentalmente che la concentrazione di una soluzione acquosa in equilibrio con neon ad una pressione di 3,00 atm e 25 ° C è 0,00135 mol/L. Determina la costante della legge di Henry per il neon in acqua a 25 ° C.
Soluzione:
Secondo la legge di Henry:
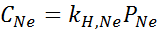
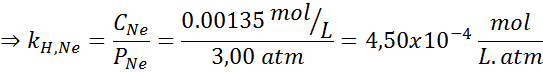
Pertanto, la costante della legge di Henry per il neon in acqua a 25 ° C è 4,50 × 10-4 mol/l.ATM.
Esempio 2: determinazione della solubilità di un gas
Usando la costante della legge di Henry fornita nella tabella precedente, determinare la solubilità dell'anidride carbonica dell'aria in acqua a livello del mare, sapendo che la frazione molare di detto gas nell'aria è 3,14 × 10-4.
Soluzione:
A livello del mare, la pressione dell'aria è di 1 atm e la pressione parziale del CO2 Esso è dato da:
Può servirti: acido ipoyodous (Hio)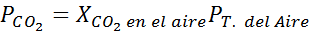
Sostituire questa espressione nella legge di Henry:
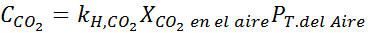
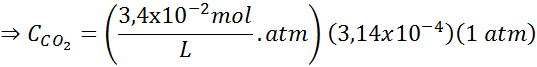
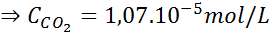
Esempio 3: gas di immersione
Quando un immersione non è una profondità superiore a 30 metri, una miscela d'aria deve respirare con altri gas inerti come elio o argon, poiché l'aumento della concentrazione di azoto nel sangue previsto da parte della legge di Henry ha effetti narcotici che causano disorientamento, confusione e visione i problemi.
Questo effetto inizia a osservare quando respira aria (xN2= 0,78) a una pressione di 4,00 atm. Se un subacqueo prevede di scendere fino a 100 metri di profondità, dove la pressione è di circa 11,0 atm, qual è la frazione massima di azoto che può respirare prima di soffrire di trafficanti di droga?
Soluzione:
Sulla base della dichiarazione, possiamo dedurre che la massima concentrazione di azoto è ciò che accade quando la pressione dell'aria è di 4,00 atm. Secondo la legge di Henry e l'utilizzo della relazione tra la pressione totale e la pressione parziale dell'esempio precedente:
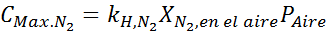
Questa deve essere la stessa concentrazione massima a qualsiasi pressione totale. Quindi, 100 metri:
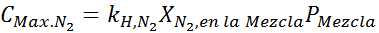
Equalizzazione di entrambe le equazioni, possiamo trovare la massima frazione molare di azoto nella miscela:
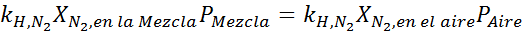
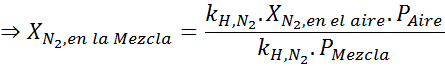
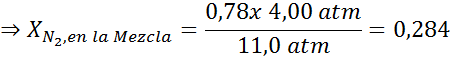
Ciò significa che il sub non dovrebbe usare una miscela contenente più del 28,4% di azoto se prevede di immergersi fino a 100 metri di profondità.

