Concetto, tipi, esempi di isoterme di adsorbimento

- 717
- 82
- Lino Lombardi
IL Isoterme di adsorbimento Sono rappresentazioni grafiche del comportamento di una particella adsorbita, sulla superficie di un solido o liquido, quando la sua concentrazione è aumentata. Se le particelle adsorbite corrispondono a quelle di un gas, la sua pressione viene presa in considerazione.
Osservando questa isoterma, è possibile prendere un'idea di come si può prendere il processo di adsorbimento; E quindi, come sono le interazioni della superficie particella e le caratteristiche della superficie. L'analisi dell'isoterma viene dedotta se la superficie è liscia, porosa o microporosa, nonché possibili condensazioni.
 Componenti necessari per il grafico o la costruzione di isoterme di adsorbimento. Fonte: Gabriel Bolívar.
Componenti necessari per il grafico o la costruzione di isoterme di adsorbimento. Fonte: Gabriel Bolívar. L'immagine superiore aiuta a chiarire il suddetto. Le particelle adsorbite (cerchi viola) sono gli adsorbati così chiamati. Mentre l'adsorbente è quello che ha un'area su cui gli adsorbati saranno adsorbiti. All'aumentare della pressione o della concentrazione, maggiore è il volume adsorbito rispetto all'adsorbente.
Questa semplice rappresentazione corrisponde a un adsorbimento descritto dall'isoterma di tipo I. Usando isoterme, adsorbenti di gas o infiniti liquidi su gel, solidi o catalizzatori sono studiati.
[TOC]
Tipi di isoterme di adsorbimento
 Isoterme di adsorbimento per sistemi solidi per gas. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Isoterme di adsorbimento per sistemi solidi per gas. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) Cinque delle principali isoterme sperimentali utilizzate da S sono mostrate sopra. Brunauer per classificare le particelle gassose sui solidi. Ognuno descrive un diverso processo di adsorbimento. Inoltre, ognuno ha modelli matematici che cercano di dedurre il comportamento delle sue curve.
Indistia di quali sono le unità o le variabili utilizzate negli assi X (P/PO) e Y (X), l'asse X indica quanta pressione o conversione di "atti" adsorbiti sul solido; Mentre l'asse Y, dice quanto di quell'adsorbato è stato davvero adsorbito sulla superficie di detto solido o adsorbente.
Può servirti: solfato di rame (CUSO4): struttura, proprietà, ottenimento, usiPertanto, mentre ci spostiamo a destra dell'asse X, vediamo come aumenta la quantità di particelle adsorbite a seconda dell'aumento delle loro pressioni o concentrazioni. Questo porta a un massimo, un decadimento, una valle, ecc., che in qualche modo o l'altro consentono di interpretare come avviene l'adsorbimento.
Isoterma di tipo I
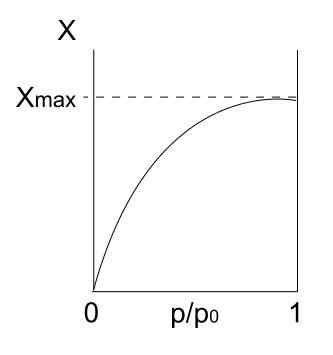 Isoterma di tipo I. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Isoterma di tipo I. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) Abbiamo l'isoterma di tipo I sopra, che è anche conosciuta come isoterma di Langmuir, poiché il suo modello prevedeva la forma di questa curva. Vedendolo, viene immediatamente interpretato che esiste una quantità massima (xmax) di particelle adsorbite, che non variano, non importa quanto le pressioni aumentino.
Questo valore di adsorbimento massimo può essere dovuto a diversi motivi. Uno di questi è che sta accadendo una chimica, il che significa che particelle o adsorbati sono fortemente legati alla superficie del solido o dell'adsorbente. Una volta che non c'è più spazio in superficie per accogliere più particelle, non ci sarà più adsorbimento.
Si dice quindi che si sia formato un monostrato (come i cerchi viola della prima immagine).
Un altro motivo per giustificare l'isoterma di tipo I è che si verifica un fisisorbimento, il che significa che le interazioni della superficie delle particelle sono molto deboli (non implicano la formazione di legami chimici).
In questo caso, le particelle finiscono per entrare in Microporos, che una volta riempiti, la superficie non avrà più posti per le seguenti adsorzioni; Cioè, ha una piccola area esterna disponibile (come se fosse un reticolo molto fine). Questo comportamento si osserva quando vengono analizzate le polveri microporose.
Può servirti: silicio: storia, proprietà, struttura, ottenimento, usiTipo isoterma Ii
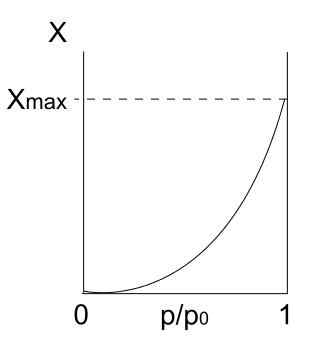
 Isoterma di tipo II. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Isoterma di tipo II. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) Up abbiamo isoterma di tipo II, noto anche come isoterma sigmoideo. Questo descrive i processi di Physis sia per solidi non porosi che per solidi macroporosi.
Si noti che all'inizio ricorda l'isoterma precedente, il che significa che le particelle adsorbite stanno formando un monostrato sulla superficie adsorbente. Una volta che il monostrato è pronto, le altre particelle verranno adsorbite in cima al primo, dando origine a multistrato. Questo è quando vediamo l'aumento caratteristico di questa isoterma (a destra).
Un altro motivo per cui si ottiene l'isoterma di tipo II è perché le particelle provano una maggiore affinità per la superficie di se stesse. Cioè, il monostrato (particelle superficie) sarà più stabile e duraturo dei multistrati (particelle-particelle) in seguito.
Tipo isoterma Iii
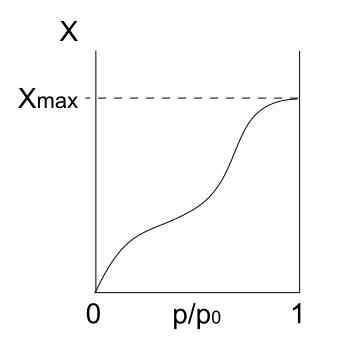
 Isoterma di tipo III. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Isoterma di tipo III. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) L'isoterma di tipo III è simile al tipo II per quanto riguarda la sua interpretazione: multicapas e physis. Tuttavia, questa volta le interazioni tra multicapas sono più forti di quelle del monostrato con la superficie del solido. Pertanto, è un adsorbimento irregolare, con tumuli di particelle adsorbite e parti di superficie libere.
Tipo isoterma IV
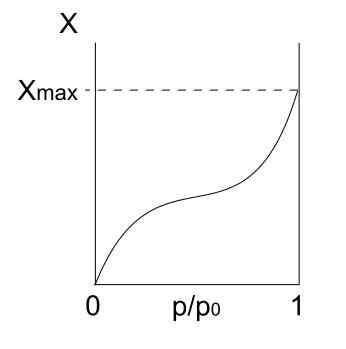
 Isoterma di tipo IV. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Isoterma di tipo IV. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) L'isoterma di tipo IV descrive anche i processi di fisisorbimento e multistrato, che assomigliano all'isoterma di tipo II; Ma ora, nei solidi porosi (e mesoporosi), dove la condensa di particelle gassose è possibile in piccoli volumi liquidi. Fino a quando il poro con liquido non sarà "coperto", il monostrato non sarà completo.
Può servirti: chimica alimentare: campo di studio, elementi, applicazioniTipo isoterma V
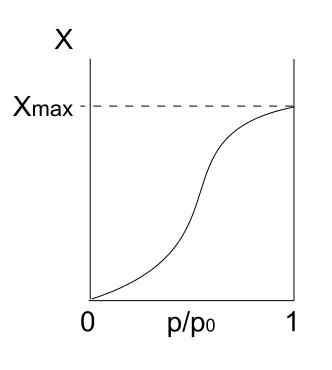 Isoterma di tipo V. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)
Isoterma di tipo V. Fonte: Daniele Pugliesi/CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0) L'isoterma di tipo V è simile al tipo IV, solo questa volta le formazioni di multicapas sono più inclini rispetto al rispettivo Mono Forpa. Cioè, ricorda l'adsorbimento descritto dall'isoterma di tipo III. Qui multicapa raggiunge uno spessore massimo, dove non ci sono posti per più particelle da adsorb.
Esempi
Alcuni esempi di sistemi solidi di gas saranno menzionati di seguito accanto al tipo di isoterme che sono state ottenute nei loro studi sperimentali:
-Ammoniaca-carbonio (tipo I)
-Azoto-zeoliti (tipo I)
-Idrogeno-carbonio ad alte temperature (tipo I)
-Negro ossigeno a carbone (tipo I)
-Azoto di silice (tipo II)
-Azoto-ierro (tipo II)
-Silice bromo-gel (tipo III)
-VAPOR IODINE SILICA (Tipo III)
-Azoto-politica (tipo III)
-Kripton-Negro di carbone (tipo IV)
-Benzene gel di ossido ferrico (tipo IV)
-Acqua vapore-carbonio (tipo V)
Si noti che i solidi menzionati erano carbone, carbone nero, ferro metallico, ossido di ferro, zeoliti e gel di silice. Tutti sono buoni esempi di adsorbenti con varie applicazioni industriali.
Riferimenti
- Walter J. Moore. (1963). Chimica fisica. In termodinamica ed equilibrio chimico. (Quarta ed.). Longmans.
- Iran. Levine. (2009). Principi di fisica. Sesta edizione, pagina 479-540. Mc Graw Hill.
- Glalasstone. (1970). Libro di testo di chimica fisica. Seconda edizione. D. Van Nostrand, Company, Inc.
- Unità 3. Fenomeni di superficie. (S.F.). Adsorbimento. [PDF]. Recuperato da: Depa.Fquim.UNAM.MX
- Lowell s., Shields J.E. (1984) isoterme di adsorbimento. In: superficie in polvere e porosità. Springer, Dordrecht.
- Elsevier b.V. (2020). Isoterma di adsorbimento. Scienceirect. Estratto da: ScienceDirect.com
- Wikipedia. (2020). Adsorbimento. Recuperato da: in.Wikipedia.org
- « Dipartimenti della regione del Pacifico in Colombia
- A cosa serve il telescopio? I 3 usi principali »

