Isóbaros
- 2088
- 341
- Kayla Serr
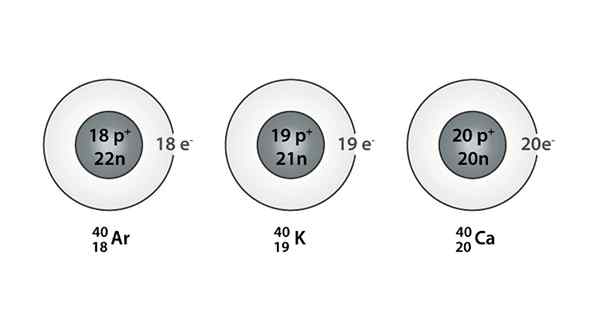
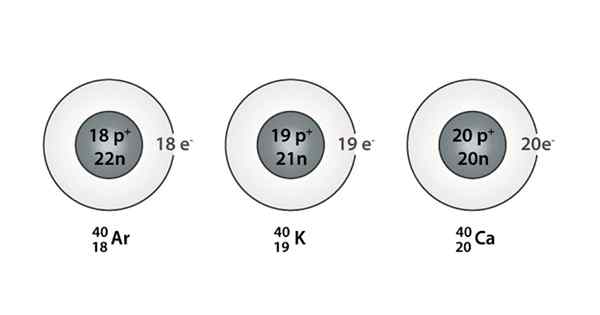 Esempio di Isóbaro; Argon, potassio e calcio, che hanno atomi della stessa massa (40)
Esempio di Isóbaro; Argon, potassio e calcio, che hanno atomi della stessa massa (40) Quali sono gli isoparos?
IL Isóbaros Sono quelle specie atomiche che hanno la stessa massa ma provengono da diversi elementi chimici. Di conseguenza, si può dire che sono costituiti da diversi numeri di protoni e neutroni.
Sia i protoni e i neutroni sono nel nucleo dei loro atomi, ma la quantità netta di neutroni e protoni presenti in ciascun nucleo rimane la stessa. In altre parole, una specie di Isóbara ha origine quando una coppia di nuclei atomici mostra lo stesso numero netto di neutroni e protoni per ogni specie.
Tuttavia, il numero di neutroni e protoni che costituiscono che l'importo netto è diverso. Un modo per notare è osservare il numero di massa (che è posizionato sul lato in alto a sinistra del simbolo dell'elemento chimico che è rappresentato), perché nelle isopie questo numero è lo stesso è lo stesso.
L'etimologia del termine isóbaro proviene dalle parole greche Isos (che significa "lo stesso") e Baros (che significa "peso"), che si riferisce all'uguaglianza dei pesi tra le due specie nucleari.
Caratteristiche degli isopari
- Gli isoparos mantengono alcune somiglianze con altre specie i cui nuclei presentano coincidenze, come il isotone, che hanno la stessa quantità di neutroni ma con numero di massa e numero atomico diverso, come i coetanei 13C e 14NO 36Sabbia 37Cl.
- Il termine "nucleide" è la denominazione che è stata coniata su ciascuno dei set di nuclea (strutture formate da neutroni e protoni) che possono essere formati. Così che i nucleidi probabilmente si distinguono per il loro numero di neutroni o protoni, o persino per la quantità di energia che la struttura del suo conglomerato possiede.
Può servirti: liquefazione: concetto, gas, terreni e sismici, seminale- Allo stesso modo, c'è un nucleo infantile dopo il β e questo processo, a sua volta, è un isopar del nucleo padre, perché il numero di nucleoni presenti nel nucleo rimane invariato, a differenza di ciò che accade per mezzo di disintegrazione α.
- È importante ricordare che i diversi isóbaros hanno un numero atomico diverso, confermando che sono diversi elementi chimici.
Rappresentazione
Per indicare i diversi nucleidi viene utilizzata una notazione specifica, che può essere rappresentata in due modi: uno consiste nel posizionare il nome dell'elemento chimico seguito dal loro numero di massa, che sono uniti da una sceneggiatura. Ad esempio: azoto-14, il cui nucleo è costituito da sette neutroni e sette protoni.
L'altro modo di rappresentare queste specie è posizionare il simbolo dell'elemento chimico, preceduto da una superstizia numerica che indica il numero di massa che l'Atomo in questione possiede, nonché un abbonamento numerico che designa il suo numero atomico, del seguente modo :
ZAX
In questa espressione x rappresenta l'elemento chimico dell'atomo in questione, a è il numero di massa (risultato dell'aggiunta tra la quantità di neutroni e protoni) e Z rappresenta il numero atomico (uguale alla quantità di protoni nel nucleo l'atomo).
Quando questi nucleidi sono rappresentati, il numero atomico dell'atomo (z) viene generalmente omesso perché non concede dati aggiuntivi pertinenti, quindi è spesso rappresentato come AX.
Un modo per mostrare questa notazione è prendere l'esempio precedente (azoto-14), che è anche indicato come 14N. Questa è la notazione usata per gli isoboo.
Può servirti: estese proprietà della materiaEsempi di Isóbaros
L'uso dell'espressione "isóbaros" per le specie note come nucleidi che hanno lo stesso numero di nucleoni (numero di massa uguale) è stato proposto alla fine degli anni '10 dal chimico di origine britannica Alfred Walter Stewart.
In questo ordine di idee, un esempio di isoboo può essere osservato nel caso delle specie 14C e 14N: il numero di massa è uguale a 14, ciò implica che il numero di protoni e neutroni in entrambe le specie è diverso.
In effetti, questo atomo di carbonio ha un numero atomico pari a 6, quindi nella sua struttura ci sono 6 protoni, e a sua volta ha 8 neutroni nel suo nucleo. Quindi il tuo numero di massa è 14 (6+8 = 14).
Da parte sua, l'atomo di azoto ha un numero atomico pari a 7, quindi è costituito da 7 protoni, ma ha 7 neutroni nel suo nucleo. Anche il tuo numero di massa è 14 (7+7 = 14).
Puoi anche trovare una serie in cui tutti gli atomi hanno un numero di massa pari a 40; Questo è il caso di Isóbaros: 40AC, 40K, 40Ar, 40Cl, e 40S.
Differenze tra isoto e isotopi
I nucleidi descrivono i diversi tipi di nuclei atomici che esistono, secondo la quantità di protoni e neutroni che possiedono.
Allo stesso modo, tra questi tipi di nucleidi sono gli isotropos e gli isotopi, che saranno differenziati di seguito.
Nel caso di Isóbaros, come accennato in precedenza, hanno lo stesso numero di nucleoni, ovvero lo stesso numero di massa -dove il numero di protoni con cui una specie è superiore all'altra concorda con il numero di neutroni che si trovano deficit, quindi il totale è lo stesso. Tuttavia, il tuo numero atomico è diverso.
Può servirti: soluzioni cristalloidi: composizione, tipi ed esempiIn questo senso, le specie isopicali provengono da diversi elementi chimici, quindi si trovano in diversi spazi della tavola periodica e hanno caratteristiche diverse e proprietà specifiche.
D'altra parte, nel caso degli isotopi accade il contrario, poiché hanno lo stesso numero atomico ma una diversa massa di massa; Cioè, hanno lo stesso numero di protoni ma un numero diverso di neutroni all'interno dei loro nuclei atomici.
Inoltre, gli isotopi sono specie atomiche appartenenti agli stessi elementi, quindi si trovano nello stesso spazio nella tavola periodica e hanno caratteristiche e proprietà simili.

