Immunoglobuline
- 4776
- 1086
- Enzo De Angelis
 Illustrazione di immunoglobuline
Illustrazione di immunoglobuline Cosa sono le immunoglobuline?
IL Immunoglobuline Sono molecole che producono linfociti B e cellule plasmatiche che collaborano con la difesa dell'organismo. Sono costituiti da una biomolecola di glicoproteina appartenente al sistema immunitario. Sono una delle proteine più abbondanti del siero di sangue, dopo l'albumina.
L'anticorpo è un altro nome che le immunoglobuline ricevono e sono considerate globuline a causa del loro comportamento nell'elettroforesi del siero del sangue che li contiene. La molecola di immunoglobulina può essere semplice o complessa, a seconda che la presentazione sia come monomero o è polimerizzata.
La struttura comune delle immunoglobuline è simile alla lettera "y". Esistono cinque tipi di immunoglobuline che hanno differenze morfologiche, funzionali e di posizione nel corpo. Le differenze strutturali degli anticorpi non sono in forma, ma in termini di composizione; Ogni tipo ha un obiettivo specifico.
La risposta immunitaria promossa dalle immunoglobuline è molto specifica ed è un meccanismo molto complesso. Lo stimolo per la sua secrezione da parte delle cellule è attivato in presenza di strani agenti al corpo, come un batterio. La funzione dell'immunoglobulina sarà quella di unirsi allo strano elemento ed eliminarlo.
Le immunoglobuline o gli anticorpi possono essere presenti sia nel sangue che sulla superficie membranosa degli organi. Queste biomolecole rappresentano elementi importanti all'interno del sistema di difese del corpo umano.
Struttura delle immunoglobuline

La struttura anticorpale contiene aminoacidi e carboidrati, oligosaccaridi. La presenza predominante di aminoacidi, la sua quantità e distribuzione è ciò che determina la struttura dell'immunoglobulina.
Come qualsiasi proteina, le immunoglobuline hanno una struttura primaria, secondaria, terziaria e quaternaria, determinando il loro aspetto tipico.
In risposta al numero di aminoacidi che presentano, le immunoglobuline hanno due tipi di catena: catena pesante e catena leggera. Inoltre, secondo la sequenza di aminoacidi nella sua struttura, ciascuna delle catene ha una regione variabile e una regione costante.
Catene pesanti
Le catene pesanti delle immunoglobuline corrispondono alle unità polipeptidiche costituite da 440 sequenze di aminoacidi.
Ogni immunoglobulina ha 2 catene pesanti e ognuna di queste ha una regione variabile e una regione costante. La regione costante ha 330 aminoacidi e gli aminoacidi variabili sequenziati.
La struttura della catena pesante è diversa per ogni immunoglobulina. Sono un totale di 5 tipi di catena pesante che determinano i tipi di immunoglobulina.
I tipi di catene pesanti sono identificati con le lettere greche γ, μ, α, ε, Δ per IgG, IgM, IgA, IgE e IgD immunoglobuline, rispettivamente.
La regione costante delle catene pesanti ε e μ sono formate da quattro domini, mentre quelli corrispondenti a α, γ, γ hanno tre. Quindi, ogni regione costante sarà diversa per ogni tipo di immunoglobulina, ma comune alle immunoglobuline dello stesso tipo.
Può servirti: muscolo sternocleidohioideLa regione variabile della catena pesante è formata da un singolo dominio di immunoglobulina. Questa regione ha una sequenza di 110 aminoacidi e sarà diversa a seconda della specificità dell'anticorpo da parte di un antigene.
Nella struttura delle catene pesanti si può osservare un'angolazione o una flessione - una cerniera - che rappresenta l'area flessibile della catena.
Catene leggere
Le catene leggere delle immunoglobuline sono polipeptidi costituiti da circa 220 aminoacidi. Esistono due tipi di catena leggera nell'essere umano: kappa (κ) e lambda (λ), quest'ultimo con quattro sottotipi. I domini costanti e variabili hanno sequenze di 110 aminoacidi ciascuno.
Un anticorpo può avere due catene leggere κ (κκ) o una coppia di catene λ (λλ) ma non è possibile possedere uno di ogni tipo contemporaneamente.
FC e segmenti FAB
Poiché ogni immunoglobulina ha una forma simile a una "y" può essere divisa in due segmenti. Il segmento "inferiore", la base, è chiamato frazione cristallizzabile o FC; mentre le braccia della "y" formano il favoloso o la frazione che unisce l'antigene. Ognuna di queste sezioni strutturali di immunoglobulina svolge una funzione diversa.
Segmento FC
Il segmento FC ha due o tre domini costanti delle catene pesanti dell'immunoglobulina.
FC può unire le proteine o un ricevitore specifico in basofili, eosinofili o cellule orzo, quindi induce la risposta immunitaria specifica che eliminerà l'antigene. FC corrisponde all'estremità carbossilica dell'immunoglobulina.
Segmento favoloso
La frazione o il segmento FAB di un anticorpo contiene i domini variabili alle sue estremità, oltre ai domini costanti delle catene pesanti e leggere.
Il dominio costante della catena pesante continua con i domini del segmento FC che formano la cerniera. Corrisponde all'estremità amino-terminale dell'immunoglobulina.
L'importanza del segmento FAB è che consente un sindacato con antigeni, sostanze strane e potenzialmente dannose.
I domini variabili di ciascuna immunoglobulina garantiscono la loro specificità da parte di un determinato antigene; Questa caratteristica consente anche il suo uso nella diagnosi di malattie infiammatorie e infettive.
Tipi di immunoglobuline
 Di Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)], via Wikimedia Commons
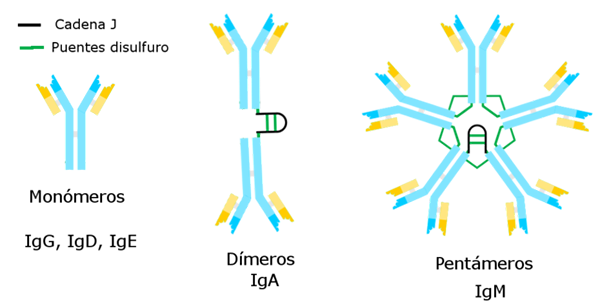
Di Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)], via Wikimedia Commons Le immunoglobuline conosciute finora hanno una catena pesante specifica che è costante per ciascuno di questi e la differenza dagli altri.
Esistono cinque varietà di catene pesanti che determinano cinque tipi di immunoglobuline, le cui funzioni sono diverse.
Immunoglobulina G (IgG)
L'immunoglobulina G è la varietà più numerosa. Ha una catena gamma pesante ed è presentata in forma unimolecolare o monomerica.
L'IgG è la più abbondante sia nel siero di sangue che nello spazio tissutale. Cambiamenti minimi nella sequenza di aminoacidi della sua catena pesante determinano la loro divisione in sottotipi: 1, 2, 3 e 4.
Può servirti: sarcomroL'immunoglobulina G ha una sequenza di 330 aminoacidi nel suo segmento FC e un peso molecolare di 150.000, di cui 105.000 corrispondono alla sua catena pesante.
Immunoglobulina M (IgM)
L'immunoglobulina M è un pentage la cui catena pesante è μ. Il suo peso molecolare è alto, circa 900.000.
La sequenza di aminoacidi della sua catena pesante è 440 nella sua frazione FC. È prevalentemente nel siero del sangue, che rappresenta il 10-12 % delle immunoglobuline. IgM ha un singolo sottotipo.
Immunoglobulina A (IgA)
La catena pesante α corrisponde ad essa e rappresenta il 15 % delle immunoglobuline totali. L'IGA si trova sia nel sangue che nelle secrezioni, anche nel latte materno, presentando sotto forma di monomero o dimero. Il peso molecolare di questa immunoglobulina è di 320.000 e ha due sottotipi: IgA1 e IgA2.
Immunoglobulina E (IGE)
L'immunoglobulina E è costituita dal tipo di catena pesante ε ed è molto scarsa nel siero, circa lo 0,002 %.
IgE ha un peso molecolare di 200.000 ed è presente come monomero principalmente nel siero, il muco nasale e la saliva. È anche comune trovare questa immunoglobulina all'interno di basofili e mastociti.
Immunoglobulina D (IGD)
La varietà a catena pesante Δ corrisponde all'immunoglobulina D, che rappresenta lo 0,2 % delle immunoglobuline totali. L'IGD ha un peso molecolare di 180.000 ed è strutturata sotto forma di monomero.
È correlato ai linfociti B, attaccati alla superficie di questi. Tuttavia, la funzione dell'IGD non è chiara.
Digitare il cambiamento
Le immunoglobuline possono sperimentare un cambiamento strutturale di tipo, a causa della necessità di difesa contro un antigene.
Questo cambiamento è dovuto alla funzione dei linfociti B di anticorpi manifatturieri mediante proprietà di immunità adattiva. Il cambiamento strutturale si trova nella regione costante della catena pesante, senza alterare la regione variabile.
Un cambio di classe o classe può causare il passaggio di una IgM a IgG o IgE, e ciò si verifica come una risposta indotta da interferone gamma o interleucine IL-4 e IL-5.
Funzioni di immunoglobuline
Il ruolo svolto dalle immunoglobuline nel sistema immunitario è di vitale importanza per la difesa dell'organismo.
Le immunoglobuline fanno parte del sistema immunitario umorale; Cioè, sono sostanze secrete dalle cellule per protezione da agenti patogeni o agenti dannosi.
Forniscono un mezzo di difesa efficace, efficace, specifico e sistematizzato, essendo di grande valore come parte del sistema immunitario. Hanno funzioni generali e specifiche all'interno dell'immunità:
Funzioni generali
Gli anticorpi o le immunoglobuline svolgono sia funzioni indipendenti che attivanti e risposte secretorie mediate dalle cellule.
Unione antigene-Accuerpo
Le immunoglobuline hanno la funzione di unire gli agenti antigenici in modo specifico e selettivo.
La formazione del complesso antigene-anticorpo è la funzione principale di un'immunoglobulina e, quindi, è la risposta immunitaria che può fermare l'azione dell'antigene. Ogni anticorpo può unirsi a due o più antigeni contemporaneamente.
Può servirti: osso alveolareFunzioni efficaci
Il più delle volte il complesso antigene-anticorpo funge da inizio per attivare specifiche risposte cellulari o iniziare una sequenza di eventi che determinano l'eliminazione dell'antigene. Le due risposte effettrici più comuni sono l'attivazione dell'unione cellulare e del complemento.
L'unione cellulare dipende dalla presenza di recettori specifici per il segmento FC di immunoglobulina, una volta che si è unito all'antigene.
Cellule come mastociti, eosinofili, basofili linfociti e fagociti possiedono questi recettori e forniscono meccanismi di eliminazione dell'antigene.
L'attivazione della cascata del complemento è un meccanismo complesso che coinvolge l'inizio di una sequenza, quindi il risultato finale è la secrezione di sostanze tossiche che eliminano gli antigeni.
Funzioni specifiche
Innanzitutto, ogni tipo di immunoglobulina sviluppa una funzione di difesa specifica:
Immunoglobulina g
- L'immunoglobulina G fornisce la maggior parte delle difese contro gli agenti antigenici, inclusi batteri e virus.
- Meccanismi attivi IgG come complemento e fagocitosi.
- La Costituzione IgG specifica per un antigene è durevole.
- L'unico anticorpo che la madre può trasferirsi ai bambini durante la gravidanza è IgG.
Immunoglobulina m
- L'IGM è l'anticorpo di risposta rapida prima degli agenti dannosi e infettivi, poiché fornisce un'azione immediata fino a quando non viene sostituita dall'IGG.
- Questo anticorpo attiva le risposte cellulari incorporate nella membrana di linfociti umorali e risposte come il complemento.
- È la prima immunoglobulina che sintetizza l'essere umano.
Immunoglobulina a
- Agisce come una barriera di difesa contro i patogeni, quando si trova sulle superfici delle mucose.
- È presente nella mucosa respiratoria, nel sistema digestivo, nel tratto urinario e anche in secrezioni come saliva, muco nasale e lacrime.
- Sebbene la sua attivazione del complemento sia bassa, può essere associato alla fluidità per eliminare i batteri.
- La presenza di immunoglobulina D sia nel latte materno che nel caloster consente a un neonato di acquisirlo durante l'allattamento al seno.
Immunoglobulina e
- Immunoglobulina e fornisce un forte meccanismo di difesa contro i produttori di allergie che producono.
- L'interazione IgE e un allergene renderà le sostanze infiammatorie responsabili dei sintomi di allergie, come starnuti, tosse, orticaria, aumento di lacrime e muco nasale.
- L'IGE può anche essere accoppiata alla superficie dei parassiti attraverso il suo segmento FC, producendo una reazione che produce la morte di questi.
Immunoglobulina d
- La struttura monomerica di IgD è collegata ai linfociti B che non hanno interagito con gli antigeni, quindi eseguono la funzione del recettore.
- La funzione di IGD non è chiara.

