Struttura di idrossido di magnesio, proprietà, nomenclatura, usi

- 4509
- 888
- Kayla Serr
Lui idrossido di magnesio È un composto inorganico la cui formula chimica è MG (OH)2. Nella sua pura forma è un solido bianco senza luminosità e aspetto amorfo; Tuttavia, con un piccolo e accurato contenuto di impurità, viene trasformato in Brucita solida cristallina, un minerale che è in alcuni depositi in natura ed è una ricca fonte di magnesio.
È un elettrolitico o una base deboli, quindi la sua dissociazione è a basso contenuto di acqua. Questa proprietà rende MG (OH)2 un buon neutralizzatore di acidità per il consumo umano; Rimedio popolare noto come sospensione del latte dalla magnesia. È anche un ritardante di incendio rilasciando acqua durante la sua decomposizione termica.
 Campione di idrossido di magnesio solido. Fonte: ChemicalIrrest [dominio pubblico]
Campione di idrossido di magnesio solido. Fonte: ChemicalIrrest [dominio pubblico] Nell'immagine superiore sono mostrati alcuni solidi di idrossido di magnesio, in cui si può vedere il suo colore bianco opaco. Più sono cristallini, sviluppano superfici vetrose e perle.
La sua struttura cristallina è peculiare poiché stabilisce cristalli esagonali a doppio livello, che sono progetti promettenti per la progettazione di nuovi materiali. In questi strati i loro carichi positivi svolgono un ruolo importante a causa della sostituzione del MG2+ da cationi trivalenti e alla specie confinata tra le pareti composte da anioni OH-.
D'altra parte, altre applicazioni derivano a seconda della morfologia delle particelle o delle nanoparticelle preparate; come catalizzatori o adsorbenti. In tutti loro, il rapporto 1: 2 per ioni mg è costante2+: OH-, riflesso nella stessa formula mg (OH)2.
[TOC]
Struttura
Formula e Octaedro
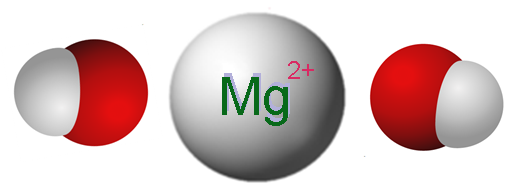 Ioni che compongono l'idrossido di magnesio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Ioni che compongono l'idrossido di magnesio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] L'immagine superiore mostra gli ioni che compongono MG (OH)2. Come si può vedere, ci sono due anioni oh- Per ogni cation mg2+, che interagiscono elettrostaticamente per definire un cristallo della struttura esagonale. La stessa formula indica che il rapporto MG: OH è 1: 2.
Tuttavia, la vera struttura cristallina è un po 'più intricata che assumere semplici ioni mg2+ e oh-. In realtà, il magnesio è caratterizzato da un numero di coordinazione di 6, quindi può interagire con un massimo di sei oh-.
Pertanto, si forma l'ottaedro MG (OH)6, dove gli atomi di ossigeno provengono ovviamente da oh-; e la struttura cristallina ora si basa sulla considerazione di tale ottaedra e su come interagiscono tra loro.
In effetti, mg (OH) unità6 Finiscono per definire le strutture a doppio strato che, a loro volta, sono ordinate nello spazio per causare il vetro esagonale.
Può servirti: peso atomicoDoppio strato
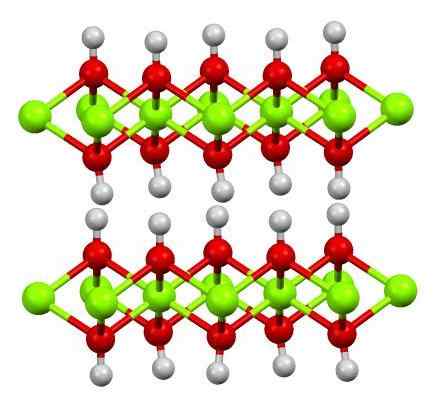 Doppio strato di idrossido di magnesio. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Doppio strato di idrossido di magnesio. Fonte: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] L'immagine superiore mostra il doppio strato di idrossido di magnesio (LDH) Doppi idrossidi a strati). Le sfere verdi rappresentano ioni mg2+, che potrebbe essere sostituito da altri con un carico maggiore per generare un carico positivo nel livello.
Nota che intorno a ogni Mg2+ Ci sono sei sfere rosse collegate alle rispettive sfere bianche; Cioè, le unità ottaedriche MG (OH)6. OH- Agisce come un ponte per unirsi a due mg2+ di piani diversi, il che fa limitare gli strati.
Allo stesso modo, si osserva che gli atomi di idrogeno si puntano su e giù e sono i primi responsabili delle forze intermolecolari per mantenere insieme i due strati di Mg (OH)6.
Tra questi strati, molecole neutre (come alcoli, ammoniaca e azoto) o persino anioni, a seconda di quanto siano positivi (se ci sono ioni3+ o fede3+ Sostituzione del Mg2+). Il "riempimento" di queste specie è limitato dalle superfici composte da anioni OH-.
Morfologie
Il vetro esagonale e doppio a strato cresce lentamente o rapidamente. Tutto dipende dalla sintesi o dai parametri di preparazione: temperatura, relazione molare, agitazione, solventi, reagenti come fonte di magnesio, basi o agenti precipitanti, ecc. Man mano che il vetro cresce, definisce la microstruttura o la morfologia delle sue nanoparticelle o aggregati.
Pertanto, queste nanoparticelle possono avere piatti, piastrine o cavolfiore. Allo stesso modo, la distribuzione delle sue dimensioni può cambiare, nonché il grado di porosità dei solidi risultanti.
Proprietà
Aspetto fisico
È un solido bianco, granulato o in polvere e toilette.
Massa molare
58.3197 g/mol.
Densità
3,47 g/ml.
Punto di fusione
350 ºC. A questa temperatura si rompe nell'ossido rilasciando le molecole d'acqua contenute nei loro cristalli:
Mg (oh)2(s) => mgo (s) +h2O (g)
Solubilità dell'acqua
0,004 g/100 ml a 100 ° C; Cioè, riesce a malapena a dissolversi in acqua bollente, quindi è un composto insolubile in acqua. Tuttavia, diminuendo il pH (o aumentando l'acidità) la sua solubilità è aumentata dalla formazione del complesso ACUO, MG (OH2)6.
D'altra parte, se il MG (OH)2 ha assorbito CO2, rilascerà il gas trattenuto come effervescenza quando si dissolve in un mezzo acido.
Può servirti: elio: storia, proprietà, struttura, rischi, usiIndice di rifrazione
1.559
ph
Una sospensione acquosa ha un pH che varia tra 9,5 e 10,5. Sebbene questi valori siano normali, riflette la sua piccola basicità contro altri idrossidi metallici (come NaOH).
Capacità termica
77.03 J/mol · K
Dove si trova?
 Blu blu blu blu. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Blu blu blu blu. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] L'idrossido di magnesio può essere trovato in natura come il minerale Brucita, che è caratterizzato dal suo colore bianco trasparente, con toni verdi o bluastri a seconda delle sue impurità. Allo stesso modo, la Brucita fa parte di alcune argille, come il clorito, quando si intervallano tra gli strati di silicati, uniti da ioni metallici.
A La Brucita ci sono altri ioni oltre a MG2+, Come Al3+, Fede3+, Zn2+ e Mn2+. Le loro mena possono essere trovate in diverse regioni o laghi di Scozia, Canada, Italia e USA.
Fisicamente i loro cristalli vedono.
Questo minerale è uno dei mali che colpiscono cementi e cemento, poiché tende ad espandersi e causare fratture in essi. Tuttavia, non assorbe CO2, Quindi la sua calcinazione non contribuisce all'effetto serra e, quindi, è una fonte mineralogica appropriata (e la più ricca) per ottenere il magnesio, oltre all'acqua di mare.
Nomenclatura
Il mg (oh)2 Ha fino a tre nomi accettati dall'IUPAC (per mineralogia o medicina). Questi sono molto simili tra loro, poiché proprio come finiscono.
Ad esempio, l '"idrossido di magnesio" corrisponde al suo nome in base alla nomenclatura dello stock, omettendo il (ii) alla fine perché il +2 è quasi per impostazione predefinita l'unico stato di ossidazione del magnesio.
"Diidrossido di magnesio", indicando il prefisso del numeratore greco il numero di ioni OH- indicato nella formula secondo la nomenclatura sistematica. E "idrossido magnetico", terminando con il suffisso -ico per essere lo stato massimo e "unico" di ossidazione del magnesio, secondo la nomenclatura tradizionale.
Gli altri nomi, come Brucita o Magnesia Milk, sebbene siano direttamente correlati a questo composto, non è conveniente riferirsi ad esso quando si tratta del suo più puro solido o come composto inorganico (reagente, materia prima, ecc.).
Applicazioni
Neutralizzatore
Il mg (oh)2 A causa della sua bassa solubilità in acqua, il fatto che si tratta di un eccellente neutralizzatore di acidità; Altrimenti, il mezzo baserebbe quando contribuisce a grandi concentrazioni di ioni OH-, Come fanno altre basi (elettroliti forti).
Può servirti: ibridazione chimicaQuindi, il mg (oh)2 Rilasciare a malapena oh-, Allo stesso tempo, reagisce con ioni H3O+ Formare il complesso di magnesio, anche menzionato sopra. Essere in grado di neutralizzare l'acidità dei media acquosi, è destinato al trattamento delle acque reflue.
È anche un additivo di cibo, fertilizzanti e alcuni prodotti di igiene personale, come il dentifricio, poiché la sua acidità diminuisce.
Antiacido
Essendo poco solubile in acqua, può essere assunto senza correre il rischio degli effetti dei suoi ioni OH- (pochissimi dissociati come l'elettrolita debole).
Questa caratteristica, legata alla sottoparte dall'alto, rende un antiacido per trattare l'acidità dello stomaco, le malattie gastrointestinali, l'indigestione e la costipazione, vendute sotto la formula del latte di magnesia.
D'altra parte, il latte di magnesia aiuta anche a combattere le fastidiose facies (le piaghe bianche e arrossate che appaiono in bocca).
Ignifugo
Nella sezione Proprietà, è stato menzionato che il MG (OH)2 Si rompe rilasciando acqua. Proprio, tale acqua aiuta a fermare l'avanzamento delle fiamme, poiché assorbono il calore per vaporizzare e, a loro volta, i vapori diluiscono gas combustibili o infiammabili.
Il minerale di Brucita viene generalmente utilizzato a questo scopo, inteso come riempimento di determinati materiali, come plastica di diversi polimeri (PVC, resine, gomme), cavi o soffitti.
Catalizzatore
Il mg (oh)2 Sintetizzato come nanoplaquetas ha dimostrato di essere efficienti per catalizzare riduzioni chimiche; Ad esempio, il 4-nitrofenolo (PH-NO2) Un 4-aminofenolo (PH-NH2). Hanno anche attività antibatterica, quindi potrebbe essere usato come agente terapeutico.
Assorbente
Alcuni solidi mg (oh)2 Possono essere piuttosto porosi, a seconda del metodo della loro preparazione. Pertanto, trovano l'applicazione come adsorbenti.
Nelle soluzioni acquose possono adsorbirsi (sulle loro superfici) le molecole da colorare, chiarire l'acqua. Ad esempio, sono in grado di assorbire il colorante in Indigo Carmine presente nelle correnti d'acqua.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Idrossido magnesio. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Idrossido magnesio. Database PubChem. CID = 14791. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Gallerie di ametista. (2014). Il brucite minerale. Recuperato da: gallerie.com
- Henrist et al. (2003). Studio morfologico delle nanoparticelle di idrossido di magnesio
- precipitato in una soluzione acquosa diluita. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad r. S. (2018). Sintesi e analisi strutturale delle nanoparticelle di idrossido di magnesio mesoporoso come catalizzatore efficiente.
- Thimmasandra Narayan Ramesh e Vani Pavada Sreenivasa. (2015). Rimozione del colorante carminio indaco dalla soluzione acquosa mediante idrossido di magnesio come adsorbente. Journal of Materials, vol. 2015, ID articolo 753057, 10 pagine. doi.org/10.1155/2015/753057
- « Storia del nichel, proprietà, struttura, usi, rischi
- Carlos Pellicer Chamber Biografia, stile, opere, frasi »

