Struttura di idrossido di alluminio, proprietà, usi, rischi
- 4494
- 1370
- Rufo Longo
Lui idrossido di alluminio È un composto inorganico la cui formula chimica è a (OH)3. A differenza di altri idrossidi metallici, è anfotero, in grado di reagire o comportarsi come un acido o una base, a seconda del mezzo. È un solido bianco abbastanza insolubile in acqua, quindi trova l'uso come componente di antiacidi.
Come il mg (oh)2 o la Brucita, con la quale condivide alcune caratteristiche chimiche e fisiche, sembra puramente un amorfo e solido brillante; Ma quando cristallizza con alcune impurità acquisisce forme cristalline come se fossero perle. Tra questi minerali, fonti naturali di Al (OH)3, è la Gibbsita.
 Special Gibbsita Crystal. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Special Gibbsita Crystal. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] Oltre al gibbsite ci sono anche i minerali Bayerite, Nordstrandite e Doleyíta, formando i quattro polimorfi di idrossido di alluminio. Strutturalmente sono molto simili tra loro, differenziandosi a vicenda nel modo in cui gli strati o i fogli ionici sono situati o accoppiati, nonché il tipo di impurità contenute.
Controllando i parametri di pH e sintesi, uno di questi polimorfi può essere preparato. Allo stesso modo, alcune specie chimiche di interesse possono essere intervallate tra i loro strati, in modo che vengano creati materiali o composti di intervalli. Ciò rappresenta l'uso di più approccio tecnologico ad Al (OH)3. Gli altri suoi usi sono come antiacidi.
D'altra parte, viene utilizzato come materia prima per ottenere allumina e le sue nanoparticelle sono state utilizzate come supporto catalitico.
[TOC]
Struttura
Formula e Octaedro
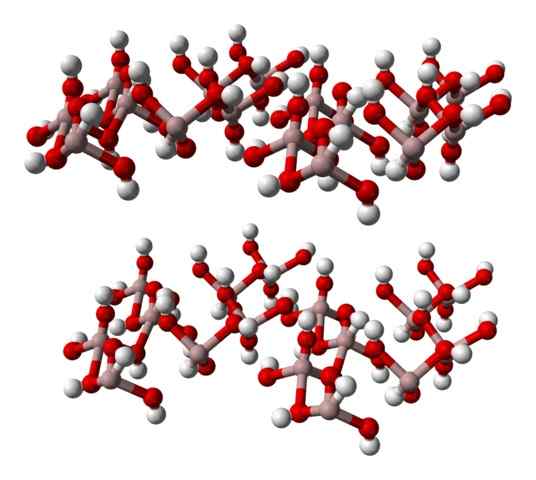
La formula chimica a (OH)3 indica una volta che la relazione a3+: OH- È 1: 3; Cioè, ci sono tre anioni oh- per ogni catione a3+, Il che è lo stesso di dire che la terza parte dei suoi ioni corrisponde all'alluminio. Quindi, al3+ e oh- Interagiscono elettrostaticamente fino a quando le loro refulsioni di attrazioni non definiscono un cristallo esagonale.
Tuttavia, al3+ Non è necessariamente circondato da tre oh- ma sei; Pertanto, si parla di un ottaedro di coordinamento, a (OH)6, in cui ci sono sei interazioni al-o. Ogni ottaedro rappresenta un'unità con cui è costruito il vetro e alcuni di essi adottano strutture tricliniche o monocliniche.
L'immagine inferiore rappresenta parzialmente l'ottaedra a (OH)6, Poiché si osservano solo quattro interazioni3+ (sfere marrone chiaro).
 Gibbsite Glass esagonale, un minerale di idrossido di alluminio. Fonte: Benjah-BMM27 [dominio pubblico].
Gibbsite Glass esagonale, un minerale di idrossido di alluminio. Fonte: Benjah-BMM27 [dominio pubblico]. Se questa struttura è attentamente osservata, che corrisponde a quella del minerale di gibbsite, si può contemplare che le sfere bianche integrano le "facce" o le superfici degli strati ionici; Questi sono, gli atomi di idrogeno degli ioni OH-.
Può servirti: affitto alogenuro: proprietà, ottenimento, esempiSi noti che esiste uno strato A e un altro b (spazialmente non sono identici), insieme tra loro da ponti idrogeno.
Polimorfi
Gli strati A e B non sono sempre accoppiati allo stesso modo, così come i loro ambienti fisici o ioni ospiti (sali) possono cambiare. Di conseguenza, i cristalli di Al (OH)3 Variano in quattro forme mineralogiche o, in questo caso, polimorfo.
Si dice quindi che l'idrossido di alluminio ha fino a quattro polimorfi: gibbsite o idragilite (monoclino), bayerite (monoclinica), doyleíta (triciclaggio) e Nordstrandite (Trichlinic). Di questi polimorfi, Gibbsita è la più stabile e abbondante; Gli altri sono classificati come minerali rari.
Se i cristalli fossero osservati al microscopio, si vede che la loro geometria è esagonale (anche se un po 'irregolare). Il pH svolge un ruolo importante nella crescita di tali cristalli e nella struttura risultante; cioè, dato un polimorfo PH A o altro può formare.
Ad esempio, se il mezzo in cui l'AL (OH) precipita3 Ha un pH inferiore a 5,8 gibbsita; Mentre se il pH è maggiore di questo valore, si forma la bayerita.
Nei media più basilari, i cristalli di Nordstrandita e Doyleíta tendono a formarsi. Pertanto, essendo il gibbsite più abbondante, è un fatto che riflette l'acidità dei suoi ambienti di agenti atmosferici.
Proprietà
Aspetto fisico
Solido bianco che può essere disponibile in diversi formati: granulato o polvere e aspetto amorfo.
Massa molare
78.00 g/mol
Densità
2,42 g/ml
Punto di fusione
300 ° C. Non ha un punto di ebollizione perché l'idrossido perde acqua per trasformarsi in allumina o ossido di alluminio, a2O3.
Solubilità dell'acqua
1 · 10-4 G/100 ml. Tuttavia, la sua solubilità aumenta con l'aggiunta di acidi (H3O+) o alcali (oh-).
Prodotto di solubilità
Ksp = 3 · 10−34
Questo piccolo valore significa che solo una piccola porzione si dissolve in acqua:
Al (Oh)3(sale3+(AC) +3OH-(AC)
E in effetti questa spregevole solubilità lo rende un buon neutralizzatore di acidità, dal momento che non basa troppo l'ambiente gastrico per non aver rilasciato quasi ioni oh-.
Anfoterismo
AL (OH)3 È caratterizzato dal suo carattere anfoter; cioè, può reagire o comportarsi come se fosse un acido o una base.
Ad esempio, reagire con ioni H3O+ (Se il mezzo è acquoso) per formare il complesso acuo [a (OH2)6"3+; che a sua volta viene idrolizzato per acidificare l'ambiente, quindi l'AL3+ uno ione acido:
Può servirti: reazione di cannizzaro: caratteristiche, meccanismi, esempiAl (Oh)3(s) +3h3O+(AC) => [Al (OH2)6"3+(AC)
[Al (oh2)6"3+(AC) +H2O (l) [al (oh2)5(OH)]2+(AC)+H3O+(AC)
Quando ciò accade, si dice che Al (oh)3 Si comporta come una base, poiché reagisce con h3O+. D'altra parte, puoi reagire con l'OH-, comportarsi come un acido:
Al (Oh)3(s) +oh-(AC) => AH (OH)4-(AC)
In questa reazione il precipitato bianco di Al (OH)3 Si dissolve nell'eccesso di ioni oh-; Il fatto che non accade lo stesso con altri idrossidi, come il magnesio, Mg (OH)2.
AL (OH)4-, ioni di alluminare, può essere espresso in modo più appropriato come: [Al (OH2)2(OH)4"-, evidenziando il numero di coordinamento di 6 per il catione a3+ (The Octaedro).
Questo ione può continuare a reagire con più oh- Fino all'ottaedro di coordinamento: [Al (OH)6"3-, chiamato ione hexahidroxoaluminato.
Nomenclatura
Il nome "idrossido di alluminio", che ha più fatto riferimento a questo composto, corrisponde al governato dalla nomenclatura delle scorte. Il (iii) viene omesso alla fine, poiché lo stato di ossidazione dell'alluminio è +3 in tutti i suoi composti.
Gli altri due possibili nomi per fare riferimento ad Al (OH)3 Sono: triidrossido di alluminio, secondo la nomenclatura sistematica e l'uso di numeratori greci; e idrossido di alluminio, terminando con il suffisso -ico per avere un singolo stato di ossidazione.
Sebbene nel campo chimico la nomenclatura di Al (OH)3 Non rappresenta alcuna sfida o confusione, al di fuori di esso tende ad essere mescolato con le ambiguità.
Ad esempio, Gibbsita Mineral è uno dei polimorfi naturali di Al (OH)3, a cui si chiamano anche γ-al (OH)3 o α-al (OH)3. Tuttavia, α-al (OH)3 Può anche corrispondere al minerale Bayerita o β-al (OH)3, Secondo la nomenclatura cristallografica. Nel frattempo, i polimorfi di Nordstrandita e Doyleita sono generalmente designati semplicemente come (OH)3.
Il seguente elenco riassume chiaramente il nuovo spiegato:
-Gibbsita: (γ o α) -al (OH)3
-Bayerita: (α o β) -al (OH)3
-Nordstrandita: Al (OH)3
-Doyleita: al (oh)3
Applicazioni
Materia prima
L'uso immediato per l'idrossido di alluminio è come materia prima per la produzione di allumina o altri composti, inorganici o organici, alluminio; Ad esempio: ALCL3, Per no3)3, Alf3 o naal (oh)4.
Supporti catalitici
Al (OH) Nanoparticelle3 Possono agire come supporto catalitico; Cioè, il catalizzatore si unisce a loro per essere fissati sulla loro superficie, dove le reazioni chimiche sono accelerate.
Può servirti: reazione di sintesi: tipi, fattori, esempiComposti internazionali
Nella sezione della struttura è stato spiegato che l'AL (OH)3 È costituito da strati o fogli A e B, accoppiati per definire un cristallo. All'interno, ci sono piccoli spazi ottaedrici o cavità che possono essere occupate da altri ioni, molecole metalliche o organiche o neutre.
Quando i cristalli vengono sintetizzati da (OH)3 Con queste modifiche strutturali, si dice che venga preparato un composto di intercalazione; cioè, intervallati o metti specie chimiche tra i fogli A e B. In tal modo, sorgono nuovi materiali fabbricati da questo idrossido.
Ignifugo
AL (OH)3 È un buon ritardante di incendio che trova l'applicazione come materiale di riempimento di molte matrici polimeriche. Questo perché assorbe il calore per rilasciare il vapore acqueo, come fa MG (OH)2 o la Brucita.
Medicinale
AL (OH)3 È anche un'acidità neutralizzante, reagendo con l'HCL di secrezioni gastriche; Ancora una volta, simile a come accade con MG (OH)2 di latte di magnesia.
Entrambi gli idrossidi possono essere miscelati in diversi antiacidi, utilizzati per alleviare i sintomi delle persone che soffrono di gastrite o ulcere allo stomaco.
Assorbente
Quando è riscaldato al di sotto del suo punto di fusione, l'idrossido di alluminio viene trasformato in allumina attivata (nonché carbonio attivo). Questo solido è usato come adsorbente di molecole indesiderate, coloranti, impurità o gas inquinanti.
Rischi
I rischi che possono rappresentare l'idrossido di alluminio non sono dovuti come solidi, ma come medicina. Non sono necessari protocolli o regolamenti per conservarlo, poiché non reagisce vigorosamente con gli agenti ossidanti e non è neanche infiammabile.
Se ingeriti in antiacidi raggiunti nelle farmacie, possono apparire effetti collaterali indesiderati, come la costipazione e l'inibizione dell'intestino fosfato. Inoltre, e sebbene non ci siano studi per dimostrarlo, è stato associato a disturbi neurologici come la malattia di Alzheimer.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Aluminio idrossido. Recuperato da: in.Wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Aluminio idrossido. Database PubChem. CID = 10176082. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Danielle Reid. (2019). Aluminio idrossido: formula ed effetti collaterali. Studio. Recuperato da: studio.com
- Robert Schoen e Charles e. Roberson. (1970). Strutture di idrossido di alluminio e implicazioni geochimiche. The American Mineralogist, vol 55.
- Vitaly p. Isupov e col. (2000). Sintesi, struttura, proprietà e applicazione di composti di intercalazione dell'idrossido di alluminio. Chimica per lo sviluppo sostenibile 8.121-127.
- Droghe. (24 marzo 2019). Effetti collaterali dell'idrossido di alluminio. Recuperato da: droghe.com
- « Storia, proprietà, struttura, struttura del vanadio
- Storia del nichel, proprietà, struttura, usi, rischi »

