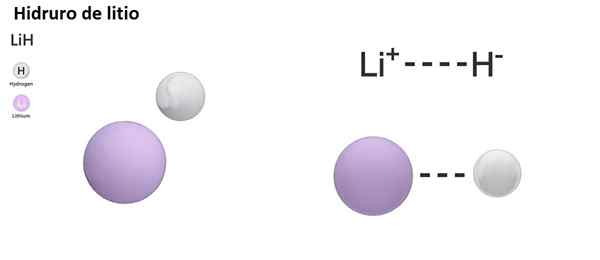Idrori
- 4735
- 1055
- Enzo De Angelis
Cosa sono gli idruros?
Gli idros sono composti chimici che derivano dalla reazione di idrogeno con elementi metallici (sodio, potassio, calcio, ecc.) e non metalli (cloro, fluoro, ossigeno, azoto, carbonio, ecc.). L'idrogeno reagisce con quasi tutti gli elementi chimici, quindi gli idrori sono sostanze molto diverse.
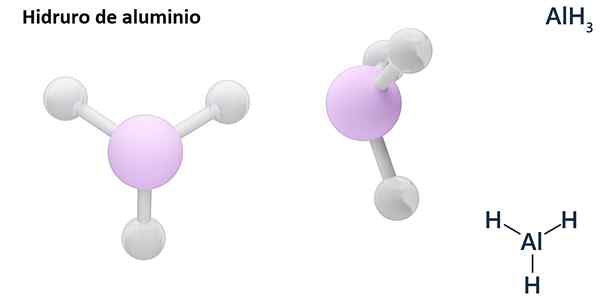
Le sue formule generali possono essere il tipo MHN, Dove m è metal e N Il suo Valencia (+1, +2, +3), come l'idruro di alluminio, Alh3; o del tipo EHN o hNE, dove E è un elemento non metallico e N È Valencia, come NH3 o h2S.
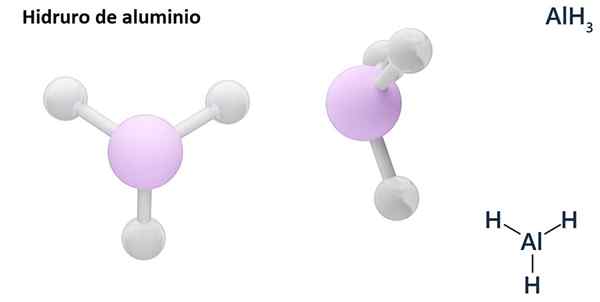
Gli idros sono generalmente composti binari, cioè derivano dalla combinazione di idrogeno con un altro elemento chimico. Tuttavia, l'idrogeno può anche stabilire combinazioni con diversi elementi chimici, per formare idrori più complessi. Tutti gli idrori spiegati saranno binari, come ALH3 e nah.
Esistono tre tipi di idrori in base alla natura del suo legame chimico: ionico, molecolare e metallico. Gli idrori ionici o salini sono caratterizzati dalla presenza di un legame ionico. Questo collegamento consiste nell'attrazione elettrica tra il carico positivo di un metallo alcalino (NA+) o alcaline-bundle (mg2+) e il carico negativo dell'anione idruro (H-).
Gli idruri molecolari, d'altra parte, sono caratterizzati dalla formazione di un legame covalente tra idrogeno e un elemento non metallico. Tra gli elementi non metallici che formano idros ci sono: cloro, bromo, fluoro, iodio, ossigeno e azoto.
E gli idrori metallici derivano dalla combinazione di idrogeno con alcuni metalli di transizione. Questo tipo di idruri, a differenza di quelli precedenti, ha strutture complesse e non sarà spiegato qui.
Proprietà idros
Le proprietà degli idrane variano a seconda del tipo di idruro: ionico, molecolare o metallico, quindi le loro proprietà devono essere indicate separatamente.
Idrori ionici o salini
Sono solidi bianchi cristallini, ma a causa della presenza di impurità acquisiscono un colore grigiastro. Questi idruri non sono solubili in solventi comuni, come acqua, alcol, ecc. Hanno anche alti punti di ebollizione e fusione.
Hanno una densità di stato elevata e fusa può condurre elettricità.
Gli hydurn ionici sono considerati basilari o alcalini, poiché disciolti in idrossidi a forma di acqua e rilasciano idrogeno molecolare:
Nah +h2O → h2 + Naoh
La reazione dell'idruro ionico con acqua è molto vigorosa e pericolosa: produce idrogeno in forma di gas, che è un materiale combustibile e infiammabile.
Gli hydurn ionici possono anche reagire con alogenuri metallici, formati da un metallo e un non metal noto come alogeno (MX, X = F, Cl, Br, I):
Può servirti: dimetilanilina: struttura, proprietà, sintesi, usi4 lih +alcl3 → Lialh4 + 3 Licl
Lih (idruro di litio) è un composto binario; mentre il LIALH4 (Litio e idruro di alluminio) è un composto ternario, cioè è costituito da tre elementi chimici.
Idro molecolare o covalente
Sono in stato liquido o gassoso a differenza degli idrori ionici, che sono solidi. Hanno bassi punti di ebollizione e fusione, osservando che aumentando il peso molecolare dell'idruro, aumenta il punto di ebollizione; Tranne l'ammoniaca (NH3), Acqua (h2O) e idruro di fluoro (HF).
Gli idruri covalenti sono scarsi conduttori di elettricità e molte delle loro proprietà sono dovute alla formazione di ponti idrogeno. Gli idruri covalenti sono considerati acidi, poiché disciolti in acqua possono causare acidi, ad esempio acido cloridrico.
Idrori metallici
Sono in stato solido, presentando il tono scuro dei metalli. Sono buoni conduttori di elettricità e hanno superfici brillanti. Gli idruri metallici che sono stabili nell'aria diventano reagenti quando si riscaldano, ad esempio l'idruro di uranio (uh3) Presenta questa proprietà.
Nomenclatura
Il modo per nominare gli idrori è semplice e non varia troppo in nessuna delle nomenclature. Se il metallo o l'elemento metallico ha più di una valenza, è specificato tra parentesi e con il numero romano secondo la nomenclatura azionaria.
Ad esempio, il feh3 è chiamato ferro idruro (iii) e coh2 Cobalt Hydro (II). Questi stessi idruri possono anche essere nominati utilizzando la nomenclatura sistematica, che utilizza i numeri greci (DI, TRI, TETRA, ecc.). Quindi, il feh3 è chiamato triidride di ferro e coh2 cobalt dihyduro.
La nomenclatura classica non è ampiamente utilizzata per l'idros. Ad esempio, NAH è noto più come idruro di sodio e non idruro di sodio.
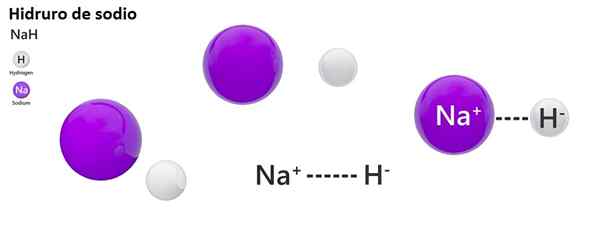 Idruro di sodio
Idruro di sodio Come si formano idros?
Idrori ionici o salini
Sono formati dalla reazione di idrogeno con un metallo appartenente al gruppo di metalli alcalini o dal gruppo di metalli alcalini-terroro.
Negli idrori addestrati con questi metalli, l'idrogeno si trova nella forma H-, noto come anione idruro.
I metalli alcalini (litio, sodio, potassio, rubidio e cesio) reagiscono con l'idrogeno per formare i loro corrispondenti hydurn:
2 m (l)+h2(g) → 2mh (s)
Può servirti: operazioni unitarieIl metallo M quando la reazione è in uno stato liquido e idrogeno in stato gassoso, quindi la reazione richiede alte temperature e alte pressioni. Considera il seguente esempio:
2 li (l) +h2 (g) → 2 lih (s)
La reazione di idrogeno con metalli alcalini-terzo (berillio, magnesio, calcio, stronzio e bario), per la formazione di idruro, è simile a quella osservata con metalli alcalini.
Il magnesio e il berillio formano idruri, ma i loro legami con idrogeno sono di tipo covalente; Cioè, non -ionico, a differenza di altri metalli alcalini:
Ca (L) +H2 (g) → Cah2 (S)
Idrori molecolari
L'idrogeno può reagire con non metalli, corrispondente ai gruppi 14, 15, 16 e 17 della tavola periodica, per formare idrori molecolari. Considera, ad esempio, la formazione di idruro di fluoro mediante combinazione o miscela diretta di idrogeno con fluoro:
H2 (g) +f2 (g) → 2 HF (G)
HF è noto più come fluoruro di idrogeno, ma è anche chiamato idruro di fluoro.
Inoltre, l'idrogeno può reagire con ossigeno (gruppo 16 della tabella periodica) seguendo lo stesso schema:
2 h2 (g) +o2 (g) → 2 h2O (g)
La reazione richiede l'alimentazione di calore per produrre ossido di idrogeno (acqua) o idruro di ossigeno.
Inoltre, l'idrogeno può reagire con azoto, appartenente al gruppo 15 della tavola periodica per formare idruro di azoto, meglio noto come ammoniaca (NH3).
N2 (g) +3 H2 (g) → 2 NH3 (G)
La reazione richiede l'alimentazione di calore, l'alta pressione e la presenza di catalizzatori (accelerano le reazioni chimiche).
Idrori metallici
Sono formati dalla reazione dei metalli di transizione (gruppi 3, 4, 5, 6, 10, 11 e 12 della tavola periodica) con idrogeno. Tuttavia, i metalli di transizione dei gruppi 7, 8 e 9 non formano composti con idrogeno, un fenomeno noto come gap di idruro o di gap idruro.
Una caratteristica unica degli idrori di metalli di transizione è che non presentano sempre una proporzione fissa tra il numero di atomi di idrogeno e il numero di atomi presenti nell'idruro. Cioè, le loro formule e strutture non sono semplici da rappresentare.
Usi/applicazioni di idro
 Gli idros sono molto presenti in uno dei tanti tipi di batterie: come NIMH. Fonte: MultiTherry, CC BY-SA 4.0, via Wikimedia Commons
Gli idros sono molto presenti in uno dei tanti tipi di batterie: come NIMH. Fonte: MultiTherry, CC BY-SA 4.0, via Wikimedia Commons Gli idros sono presenti nelle batterie a idruro metallico nichel (NIMH), usate congiuntamente con metalli delle terre rare, cobalto o manganese. Diversi idrori metallici sono stati esaminati per l'uso in auto elettriche guidate da cellule correlate all'idrogeno.
Può servirti: metodo di bilanciamento redox: passaggi, esempi, eserciziRiducendo gli agenti
Idruro di litio e boro di sodio (Nabh4) Sono usati come reazioni chimiche nelle reazioni di sintesi organica.
Stoccaggio dell'idrogeno e altri usi correlati
Esistono piloti di utilizzo dell'idrogeno come combustibile nei veicoli a motore, ma a causa della sua esplosività il suo uso è stato limitato come carburante. L'uso di idros è stato proposto come forma di accumulo di idrogeno, per controllare così il loro pericolo.
Inoltre, sono stati utilizzati idrori per la purificazione e la separazione dei sensori di idrogeno e temperatura.
Essiccanti
L'idruro di calcio viene utilizzato per rimuovere l'acqua presente nei solventi organici.
Gli acidi originati con idrori molecolari
Ad esempio: l'acido cloridrico è formato dalla soluzione in un mezzo acquoso di idruro di cloro (HCl), usando l'acido idroclorico nell'eliminazione degli ossidi che coprono il ferro, l'acidificazione dei pozzi di petrolio, la produzione del cloruro di calcio e il trattamento minerale.
Fertilizzanti
L'ammoniaca (NH3) È un idruro che viene usato come fertilizzante liquido e serve per la sintesi di composti con nitrato di ammonio e solfato di ammonio, che sono usati come fertilizzanti.
Acqua
È l'idruro più importante. È utilizzato in molti settori con usi e applicazioni diversi. L'acqua è il principale responsabile dell'esistenza di esseri viventi.
Esempi di idrori
Infine, altri esempi di idrori saranno elencati con le rispettive formule e nomi:
SNH4: idruro di stagno | PH3: idruro di fosforo (fosfina) o triidride di fosforo |
KH: idruro di piombo | MGH2: idruro di magnesio o magnesio diiduro |
KH: idruro di potassio | CH4: Carruro Carruro o tetraidride di carbonio (metano) |
CAH2: idruro di calcio | FEH2: Iron Hydride (II) |
Nah: idruro di sodio | ZnH2: idruro di zinco |
Lih: idruro di litio | BAH2: idruro di bario |
CSH: cesio idruro | BH3: Boron Hydro (BAS |
Beh2: idruro di beryl o beryl diidruro | SIH4: Silicon Hydro (Silan) |
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wojes, Ryan. (27 agosto 2020). Cos'è un idruro di metallo? Recuperato da: Thoughtco.com
- Elementi americani. (2020). Idrididi. Estratto da: americani.com
- Wikipedia. (2020). Idruro. Recuperato da: in.Wikipedia.org
- Tandis Arani. (15 agosto 2020). Idrididi. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- I redattori di Enyclopedia Britannica. (2020). Idruro. Recuperato da: Britannica.com