Struttura di idruro al litio, proprietà, ottenimento, usi
- 2962
- 602
- Benedetta Rinaldi
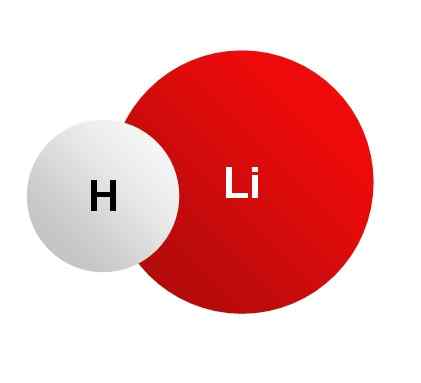
Lui Idruro di litio È un solido inorganico cristallino la cui formula chimica è lih. È il sale inorganico più chiaro, il suo peso molecolare è solo 8 g/mol. È formato dall'unione di un litio ione li+ e uno ione idruro h-. Entrambi sono uniti da un legame ionico.
Lih ha un punto di fusione elevato. Reagisce facilmente con l'acqua e nella reazione si verifica un gas idrogeno. Può essere ottenuto mediante reazione tra metallo di litio fuso e gas idrogeno. È ampiamente usato nelle reazioni chimiche per ottenere altri idrori.
 Idruro di litio, lih. Nessun autore leggibile dalla macchina fornita. Jtiago ha assunto (basato su reclami di copyright). [Dominio pubblico]. Fonte: Wikimedia Commons.
Idruro di litio, lih. Nessun autore leggibile dalla macchina fornita. Jtiago ha assunto (basato su reclami di copyright). [Dominio pubblico]. Fonte: Wikimedia Commons. Lih è stato usato per protezione contro radiazioni pericolose come quelle che si trovano nei reattori nucleari, questi sono alfa, beta, radiazioni gamma, protoni, raggi X e neutroni.
È stato anche proposto per la protezione dei materiali dei razzi spaziali spostati dalla propulsione termica nucleare. Gli studi vengono persino usati per essere usati come protezione dell'essere umano contro le radiazioni cosmiche durante i futuri viaggi sul pianeta Marte.
[TOC]
Struttura
Nell'idruro di litio, l'idrogeno ha un carico negativo H-, Bene, un elettrone ha rubato al metallo, che è sotto forma di ione li+.
Configurazione elettronica di cationi Li+ È: [lui] 1s2 che è molto stabile. E la struttura elettronica dell'idruro H- È: 1s2, che è anche molto stabile.
Il catione e l'anione si legano dalle forze elettrostatiche.
Il cristallo idruro di litio ha la stessa struttura del cloruro di sodio, cioè una struttura cristallina cubica.
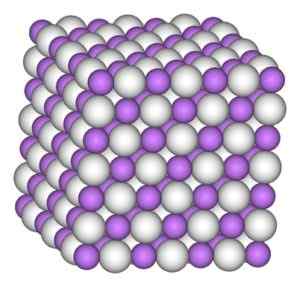 Struttura cristallina cubica di idruro di litio. Autore: Benjah-BMM27. Fonte: Wikimedia Commons.
Struttura cristallina cubica di idruro di litio. Autore: Benjah-BMM27. Fonte: Wikimedia Commons. Nomenclatura
- Idruro di litio
- Lih
Proprietà
Stato fisico
Solido cristallino bianco o incolore. Il lih commerciale può essere blu grigiastro a causa della presenza di piccole quantità di metallo al litio.
Peso molecolare
8 g/mol
Punto di fusione
688 ºC
Punto di ebollizione
Si decompone a 850 ºC.
Temperatura di autorezione
200 ºC
Densità
0,78 g/cm3
Solubilità
Reagire con l'acqua. È insolubile in eteri e idrocarburi.
Altre proprietà
L'idruro di litio è molto più stabile degli idrosi degli altri metalli alcalini e può essere fuso senza decomposizione.
Può servirti: batteria a seccoNon è influenzato dall'ossigeno se viene riscaldato a temperature al di sotto del rosso. Né è influenzato dal cloro CL2 e acido cloridrico HCL.
Il contatto con calore e umidità provoca una reazione esotermica (genera calore) e l'evoluzione dell'idrogeno H2 e idrossido di litio lioh.
Può formare una polvere fine che può sfruttare a contatto con fiamme, calore o materiali ossidanti. Non è necessario contattare l'ossido nitroso o l'ossigeno liquido, in quanto può sfruttare o attivare.
Si oscura essendo esposto alla luce.
Ottenimento
L'idruro di litio è stato ottenuto in laboratorio mediante reazione tra metallo di litio fuso e gas idrogeno a una temperatura di 973 K (700 ° C).
2 Li + H2 → 2 lih
Buoni risultati si ottengono quando la superficie esposta del litio fuso viene aumentata e quando il tempo di sedimentazione LIH viene ridotto. È una reazione esotermica.
Uso come scudo protettivo contro le radiazioni pericolose
LIH presenta una serie di caratteristiche che rendono attraente da essere utilizzata come protezione per essere umani nei reattori nucleari e nei sistemi spaziali. Ecco alcune di queste caratteristiche:
- Ha un alto contenuto di idrogeno (12,68 % in peso di H) e un elevato numero di atomi di idrogeno per unità di volume (5,85 x 1022 Atomi H/cm3).
- Il suo elevato punto di fusione consente di essere utilizzato in ambienti ad alta temperatura senza essere fondata.
- Ha una bassa pressione di dissociazione (~ 20 torr nel suo punto di fusione) che consente di gettare e congelare il materiale senza degradare a bassa pressione idrogeno.
- Ha una bassa densità che rende attraente da utilizzare nei sistemi spaziali.
- Tuttavia, i loro svantaggi sono la loro bassa conduttività termica e le cattive proprietà meccaniche. Ma questo non ha ridotto la sua applicabilità.
- Pezzi di lih che servono come scudi sono fabbricati da pressatura fredda o calda e da fusione e versano negli stampi. Sebbene quest'ultima forma sia preferita.
- A temperatura ambiente, le parti sono protette dall'acqua e dal vapore acqueo.
- Nei reattori nucleari
Nei reattori nucleari ci sono due tipi di radiazioni:
Può servirti: acidi e basi nella vita di tutti i giorni: reazioni, usi, esempiRadiazioni ionizzanti dirette
Sono particelle altamente energetiche che trasportano carica elettrica, come alfa (α) e beta (β) e particelle di protoni. Questi tipi di radiazioni interagiscono molto fortemente con i materiali degli scudi, causando la ionizzazione quando interagiscono con gli elettroni dei materiali dei materiali attraverso i quali passano.
Radiazioni ionizzanti indirettamente
Sono neutroni, raggi gamma (γ) e raggi X, che sono penetranti e richiedono protezione in massa, poiché coinvolgono l'emissione di particelle secondarie caricate, che sono quelle che causano la ionizzazione.
 Simbolo da avvertire di radiazioni pericolose. IAEA e ISO [dominio pubblico]. Fonte: Wikimedia Commons.
Simbolo da avvertire di radiazioni pericolose. IAEA e ISO [dominio pubblico]. Fonte: Wikimedia Commons. Secondo alcune fonti, LIH è efficace nel proteggere i materiali e le persone da questi tipi di radiazioni.
- Nei sistemi spaziali di propulsione termica nucleare
LIH è stato recentemente scelto come potenziale moderatore e materiale protettivo contro le radiazioni nucleari per i sistemi di propulsione termica nucleare di spazialità per viaggi molto lunghi.
 Rappresentazione artistica del veicolo spaziale con propulsione nucleare nell'orbita di Marte. NASA/SAIC/PAT RAWLINGS [dominio pubblico]. Fonte: Wikimedia Commons.
Rappresentazione artistica del veicolo spaziale con propulsione nucleare nell'orbita di Marte. NASA/SAIC/PAT RAWLINGS [dominio pubblico]. Fonte: Wikimedia Commons. La sua bassa densità e un alto contenuto di idrogeno provoca la riduzione della massa e del volume del reattore di propulsione nucleare.
- In protezione contro le radiazioni cosmiche
L'esposizione alle radiazioni spaziali è il rischio più importante di salute umana nelle future missioni di esplorazione interplanetaria.
Nello spazio profondo, gli astronauti saranno esposti allo spettro completo dei raggi cosmici galattici (ioni ad alta energia) ed eventi di eiezione di particelle solari (protoni).
Il pericolo di esposizione alle radiazioni è aggravato a causa della durata delle missioni. Inoltre, anche la protezione dei luoghi che gli esploratori.
 Simulazione di habitat futura sul pianeta Marte. NASA [dominio pubblico]. Fonte: Wikimedia Commons.
Simulazione di habitat futura sul pianeta Marte. NASA [dominio pubblico]. Fonte: Wikimedia Commons. In questo ordine di idee, uno studio condotto nel 2018 ha indicato che tra i materiali comprovati, LIH fornisce la più alta riduzione delle radiazioni per grammo per cm2, Quindi essere uno dei migliori candidati da utilizzare in protezione contro le radiazioni cosmiche. Tuttavia, questi studi devono essere approfonditi.
Uso come mezzo di conservazione e trasporto di idrogeno sicuro
Ottenere energia da H2 È qualcosa che è stato studiato per diverse decine di anni e ha già trovato applicazione per sostituire i combustibili fossili nei veicoli di trasporto.
Può servirti: equilibrio chimico: spiegazione, fattori, tipi, esempiIl h2 Può essere utilizzato nelle celle a combustibile e contribuire alla riduzione della produzione2 e nonX, evitando così l'effetto serra e l'inquinamento. Tuttavia, non è stato ancora trovato un sistema efficace per la conservazione e il trasporto di H2 Sicuramente, con peso leggero, compatto o piccolo, che lo fa rapidamente e rilascia H2 Altrettanto veloce.
L'idruro di litio Lih proviene da idrori alcalini che ha la più alta capacità di conservazione di H2 (12,7 % in peso di H). Rilascio h2 mediante idrolisi secondo la seguente reazione:
Lih + H2O → Lioh + H2
Il LIH fornisce 0,254 kg di idrogeno per ogni kg di LIH. Inoltre, ha un'elevata capacità di archiviazione per unità di volume, il che significa che è leggero ed è un mezzo compatto per l'archiviazione H2.
 Motocicletta il cui combustibile è idrogeno immagazzinato sotto forma di idruro metallico come Lih. O.S. DOE Efficienza energetica e Renewable Energy (USA) [dominio pubblico]. Fonte: Wikimedia Commons.
Motocicletta il cui combustibile è idrogeno immagazzinato sotto forma di idruro metallico come Lih. O.S. DOE Efficienza energetica e Renewable Energy (USA) [dominio pubblico]. Fonte: Wikimedia Commons. Inoltre, LIH è più facilmente formato rispetto ad altri idrori in metallo alcalino ed è chimicamente stabile a temperature e pressioni ambientali. LIH può essere trasportato dal produttore o dal fornitore all'utente. Quindi per idrolisi del lih viene generata2 E questo è usato in sicurezza.
L'idrossido di litio lioh formata può essere restituito al fornitore che rigenera il litio mediante elettrolisi e quindi prodotto di nuovo lih.
Il LIH è stato anche studiato con successo per essere utilizzato insieme all'idraccina in grassetto per lo stesso scopo.
Utilizzare nelle reazioni chimiche
Lih consente una sintesi complessa di idrori.
Serve ad esempio per preparare il trietilboroidride al litio è un potente nucleofilo nelle reazioni di spostamento di Haluros organico.
Riferimenti
- Sato, e. E Takeda, o. (2013). Sistema di stoccaggio e trasporto dell'idrogeno attraverso idruro di litio mediante tecnologia salina fusa. In sali di sali fusi. Capitolo 22, pagine 451-470. Recuperato da ScienceDirect.com.
- O.S. Biblioteca nazionale di medicina. (2019). Idruro di litio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- Wang, l. et al. (2019). Indagine sull'impatto dell'effetto del kernel temorale dell'idruro di lichium sul reattivo del nucleare. Annali di energia nucleare 128 (2019) 24-32. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Giraudo, m. et al. (2018). Test basati su accelerator per schermare l'efficacia di diversi materiali e multi-e-emergenza e ioni pesanti. Radiation Research 190; 526-537 (2018). NCBI recuperato.Nlm.NIH.Gov.
- Welch, f.H. (1974). Idruro di litio: un materiale di schermatura dell'era spaziale. Ingegneria nucleare e design 26, 3, febbraio 1974, pagine 444-460. Recuperato da ScienceDirect.com.
- Simnad, m.T.(2001). Reattori nucleari: materiali di schermatura. In Encyclopedia of Materials: Science and Technology (Second Edition). Pagine 6377-6384. Recuperato da ScienceDirect.com.
- Hügy, t. et al. (2009). Idrazina Borane: un promettente materiale di accumulo di idrogeno. J. SONO. Chimica. Soc. 2009, 131, 7444-7446. Recuperato dai pub.sindrome coronarica acuta.org.
- « AMENADIEL Significato, Presenza nella Bibbia e Lucifero
- Storia della medicina Maya, Dio, piante, malattie »

