Idrossiapatite

- 1100
- 170
- Rufo Longo
Spieghiamo cos'è l'idrossilapatite, la sua struttura, come è sintetizzata, i suoi usi e le proprietà fisiche e chimiche
 Idrossiapatite. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0, CC BY-SA 3.0, via Wikimedia Commons
Idrossiapatite. Fonte: Rob Lavinsky, Irocks.Com-CC-BY-SA-3.0, CC BY-SA 3.0, via Wikimedia Commons Cos'è l'idrossiapatite?
IL Idrossiapatite È un minerale di fosfato di calcio, la cui formula chimica è Ca10(Po4)6(OH)2. Insieme ad altri minerali e materia organica organica e compatta, forma la materia prima nota come roccia fosforica. Il termine idrossi si riferisce all'anione oh-.
Se invece di quell'anione fosse fluoruro, il minerale sarebbe chiamato fluoroapatita (CA10(Po4)6(F)2; E così con altri anioni (CL-, Br-, Co32-, eccetera.). Allo stesso modo, l'idrossiapatite è il principale componente inorganico di ossa e smalto dentale, prevalentemente presente in un cristallino.
Quindi, è un elemento vitale nei tessuti ossei degli esseri viventi. La sua grande stabilità contro altri fosfati di calcio gli consente di sostenere le condizioni fisiologiche, dando alle ossa la loro caratteristica durezza. L'idrossiapatite non è solo: soddisfa la sua funzione accompagnata da collagene, proteina fibrosa dei tessuti congiuntivi.
L'idrossipatite (o idrossilapatite) contiene ioni CA2+, Ma altri cationi possono anche ospitare nella sua struttura (MG2+, N / a+), impurità coinvolte in altri processi biochimici delle ossa (come il loro rimodellamento).
Struttura idrossiapatite
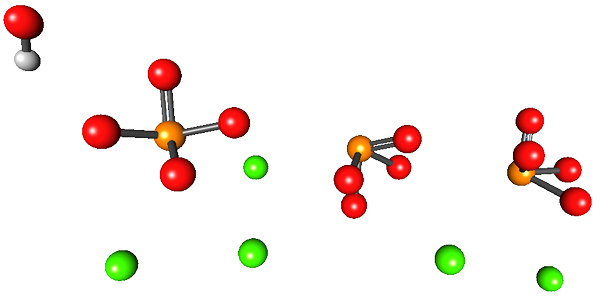
L'immagine superiore illustra la struttura dell'idrossiapatite di calcio. Tutte le sfere occupano il volume della metà di un "cassetto" esagonale, dove l'altra metà è identica al primo.
In questa struttura le sfere verdi corrispondono ai cationi2+, Mentre le sfere rosse su atomi di ossigeno, atomi da arancione a fosforo e il bianco verso l'atomo di idrogeno OH-.
Gli ioni fosfati in questa immagine hanno il difetto di non mostrare una geometria tetraedrica; Invece, sembrano piramidi a base quadrata.
Può servirti: stato vitreousOH- dà l'impressione che si trovi lontano dalla CA2+. Tuttavia, l'unità cristallina può ripetersi sul tetto del primo, mostrando così la vicinanza tra i due ioni. Inoltre, questi ioni possono essere sostituiti da altri (Na+ e f-, Per esempio).
Sintesi di idrossilapatite
L'idrossilapatite può essere sintetizzata mediante reazione di idrossido di calcio con acido fosforico:
10 ca (oh)2 + 6 h3Po4 => Ca10(Po4)6(OH)2 + 18 h2O
Idrossiapatita (CA10(Po4)6(OH)2) è espresso da due unità di formula CA5(Po4)3OH.
Allo stesso modo, l'idrossiapatite può essere sintetizzata attraverso la seguente reazione:
10 ca (no3)2.4h2O + 6 NH4H2Po4 => Ca10(Po4)6(OH)2 + 20 nh4NO3 + 52 h2O
Controllare la velocità di precipitazione consente a questa reazione di generare nanoparticelle di idrossiapatite.
Cristalli di idrossiapatite

Gli ioni sono compattati e crescono per formare un bio critico rigido e resistente. Questo è usato come biomateriale della mineralizzazione ossea.
Tuttavia, ha bisogno di collagene, supporto organico che funge da stampo della sua crescita. Questi cristalli e i loro complicati processi di formazione dipenderanno dall'osso (o dal dente).
Questi cristalli diventano impregnati di materia organica e l'applicazione di tecniche di microscopia elettronica li dettaglia nei denti come aggregati con forme a canna chiamate prismi.
Usi di idrossilapatite
Uso medico e dentale
A causa della sua somiglianza di dimensioni, cristallografia e composizione con il tessuto umano duro, la nanoidrossiapatite è attraente da usare nelle protesi. Inoltre, la nanoidrossiapatite è biocompatibile, bioattiva e naturale, oltre a non essere tossici o infiammatori.
Di conseguenza, la ceramica della nanoidrossiapatite ha una varietà di applicazioni, tra cui:
- Nella chirurgia tejido ossea viene utilizzato nel riempimento di cavità in interventi ortopedici, traumatologici, maxillofacciali e dentali.
- È usato come rivestimento ortopedico e dentale. È un agente desensibilizzante usato per lo sbiancamento dentale. Viene anche usato come agente di remineralizzazione nelle paste dentali e nel trattamento precoce della carie.
- Gli impianti in acciaio inossidabile e titanio sono spesso coperti di idrossiapatite per ridurre la velocità di rifiuto.
- È un'alternativa agli innesti di ossa alogeni e xenogenici. Il tempo di guarigione è più breve in presenza di idrossiapatite che in sua assenza.
- Nanohidroxyapatite mimetiza sintetica in idrossiapatite presente naturalmente nella dentina e enmaltica apatite, quindi il suo uso nella riparazione di smalto e incorporazione nelle paste dentali è vantaggioso, nonché nel risciacquo della bocca.
Altri usi dell'idrossiapatite
- L'idrossiapatite viene utilizzata nei filtri dell'aria dei veicoli a motore per aumentare la loro efficienza nell'assorbimento e nella decomposizione del monossido di carbonio (CO). Ciò riduce l'inquinamento ambientale.
- È stato sintetizzato un complesso di alginato-idrossiapatite che i test sul campo hanno indicato che è in grado di assorbire il fluoruro attraverso il meccanismo di scambio ionico.
- L'idrossiapitite è usato come mezzo cromatografico per le proteine. Questo ha addebiti positivi (CA++) e negativo (Po4-3), quindi può interagire con le proteine caricate elettricamente e consentire la separazione mediante scambio ionico.
- L'idrossiapatite è stata anche utilizzata come supporto per gli acidi nucleici elettrofotici. È possibile separare il DNA dall'RNA, nonché il DNA di un semplice filo dei due fili DNA.
Proprietà fisiche e chimiche
L'idrossiapatite è un solido bianco che può acquisire toni grigi, gialli e verduri. Come è un solido cristallino, presenta elevati punti di fusione, indicativi delle forti interazioni elettrostatiche; Per l'idrossiapatite, questo è 1100 ºC.
È più denso dell'acqua, con una densità di 3,05 - 3,15 g/cm3. Inoltre, è praticamente insolubile in acqua (0,3 mg/mL), dovuta agli ioni fosfati.
Tuttavia, nei mezzi acidi (come in HCl) è solubile. Questa solubilità è dovuta alla formazione di CACL2, Sale d'acqua altamente solubile. Allo stesso modo, i fosfati sono protonici (HPO42- e h2Po4-) e interagire in misura migliore con l'acqua.
La solubilità dell'idrossiapatite acida è importante nella fisiopatologia della carie. I batteri nell'acido lattico della cavità orale secernono l'acido lattico, il prodotto della fermentazione del glucosio, che riduce il pH della superficie dentale a meno di 5, quindi l'idrossiapatite inizia a dissolversi.
Può servirti: sublimazione: concetto, processo ed esempiIl fluoro (f-) Puoi sostituire ioni oh- Nella struttura cristallina. Quando ciò accade, fornisce resistenza all'idrossiapatite dello smalto dentale di fronte agli acidi.
Forse, questa resistenza può essere dovuta all'insolubilità del CAF2 formato, rifiutando di "lasciare" il vetro.
Riferimenti
- SHIVER & ATKINS. (2008). CHIMICA INORGANICA. (Quarta ed., P. 349, 627). Mc Graw Hill.
- Fluidinova. (2017). Idrossilapatite. Estratto da Fluidinova.com
- Gaiabulbanix. (5 novembre 2015). Idrossiapatite. [Figura]. Recuperato dai beni comuni.Wikimedia.org
- Martin.Neitsov. (25 novembre 2015). Hüdroksüapatiidi Kristallid. [Figura]. Recuperato dai beni comuni.Wikimedia.org
- Wikipedia. (2018). Idrossilapatite. Recuperato da.Wikipedia.org
- Fiona Petchey. Osso. C14Dating recuperato.com

