Struttura dell'idrolasasi, funzioni, esempi

- 2970
- 198
- Dott. Rodolfo Gatti
IL Idrolasi Sono enzimi che sono responsabili dell'idrolizzamento di diversi tipi di collegamenti chimici in molti composti diversi. Tra i principali collegamenti che l'idrolizzato ci sono i collegamenti estere, glucosidici e peptidi.
All'interno del gruppo di idrolasi, sono stati classificati oltre 200 diversi enzimi, raggruppati almeno 13 set individuali; La sua classificazione si basa essenzialmente sul tipo di composto chimico che funge da substrato.
 Modellazione grafica con strumenti bioinformatici della struttura di un'idrolasi (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons) tramite Wikimedia Commons)
Modellazione grafica con strumenti bioinformatici della struttura di un'idrolasi (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons) tramite Wikimedia Commons) Le idrolasi sono indispensabili per la digestione del cibo nell'intestino degli animali, poiché sono responsabili del degrado di gran parte dei collegamenti che costituiscono le strutture carbonizzate degli alimenti che ingeriscono.
Questi enzimi funzionano nei mezzi acquosi, poiché hanno bisogno di molecole d'acqua intorno a loro per aggiungere ai composti una volta divise le molecole. In parole semplici, le idrolasi eseguono una catalisi idrolitica dei composti su cui agiscono.
Ad esempio, quando un'idrolasi rompe un legame covalente C-C, il risultato è di solito un gruppo C-O e un gruppo C-H.
[TOC]
Struttura
Come molti enzimi, le idrolasi sono proteine globulari organizzate in strutture complesse organizzate attraverso interazioni intramolecolari.
Le idrolasi, come tutti gli enzimi, si legano a una o più molecole di substrato in una regione della sua struttura che è nota come "sito attivo". Questo sito è una tasca o una fessura circondata da molti residui di aminoacidi che facilitano la presa o l'unione del substrato.
Ogni tipo di idrolasi è specifico per un determinato substrato, che è determinato dalla sua struttura terziaria e dalla formazione di aminoacidi che rendono il loro posto attivo. Questa specificità è stata sollevata didattica da Emil Fischer come una sorta di "chiave e blocco".
Può servirti: polimerasi: caratteristiche, struttura e funzioniAl momento è noto che il substrato, in generale, induce cambiamenti o distorsioni nella formazione di enzimi e che gli enzimi, a loro volta, distorcono la struttura del substrato per garantire che questo "pizzo" nel suo sito attivo.
Funzioni
Tutte le idrolasi hanno la funzione principale della rottura dei legami chimici tra due composti o all'interno della struttura della stessa molecola.
Esistono idrolasi per rompere quasi ogni tipo di collegamento: alcuni degradano i legami estere tra carboidrati, altri legami peptidici tra aminoacidi proteici, altri legami carbossilici, ecc.
Lo scopo del processo di legame chimico catalizzato da un enzima idrolasi varia considerevolmente. Smozyme, ad esempio, è responsabile dell'idrolisi dei legami chimici con scopi di protezione degli organismi che lo sintetizzano.
Questo enzima degrada i collegamenti che si tengono insieme ai composti nella parete cellulare dei batteri, con l'obiettivo di proteggere il corpo umano dalla proliferazione batterica e una possibile infezione.
Le nuclea sono enzimi "fosfatasi" che hanno la capacità di degradare gli acidi nucleici, che possono anche rappresentare un meccanismo di difesa cellulare contro i virus del DNA o dell'RNA.
Altre idrolasi, come quelle del tipo "proteasi", degradano i legami peptidici delle proteine nel tratto digestivo per rendere assimilabili gli aminoacidi nell'epitelio gastrointestinale.
Anche le idrolasi sono coinvolte in vari eventi di produzione di energia nel metabolismo cellulare, poiché le fosfatasi catalizzano il rilascio di molecole di fosfato da substrati ad alta energia come il piruvato, nella glicolisi.
Può servirti: impugnatura di soiaEsempi di idrolasasi
Tra la grande diversità di idrolasi che gli scienziati hanno identificato, alcune sono state studiate con maggiore enfasi rispetto ad altri, poiché sono coinvolti in molti processi essenziali per la vita cellulare.
Tra questi ci sono la levigatezza, la proteasi serina, le fosfatasi endonucleose e glucosidasi o glicosraee.
La morbidezza
Enzimi di questo tipo di interruzione. Questo di solito finisce per causare una lisi totale dei batteri.
Gli smozymi difendono il corpo degli animali di infezioni batteriche e sono abbondanti nelle secrezioni del corpo nei tessuti che sono in contatto con l'ambiente, come, ad esempio, lacrime, saliva e mucusioni.
L'uovo di gallina liscio è stata la prima struttura proteica che si è cristallizzata attraverso i raggi x. Questa cristallizzazione è stata realizzata da David Phillips, nel 1965, al London Real Institute.
Il sito attivo di questo enzima è composto dall'asparagina-alanina-meccanina-peaspaparagina-glicina-glicina-pergina-peptide a piante-metionina (NAM-NAG-NAM).
Proteasi serin
Gli enzimi di questo gruppo sono responsabili dell'idrolizzante legami peptidici nei peptidi e nelle proteine. I più comunemente studiati sono trpsina e chimotripsina; Tuttavia, esistono molti tipi diversi di proteasi, che variano rispetto alla specificità del substrato e al suo meccanismo di catalisi.
Le "proteasi" sono caratterizzate dal possesso di un aminoacido nucleofilo di tipo serina. Proteasas Serin è anche in grado di rompere un'ampia varietà di collegamenti estere.
Può servirti: qual è la composizione chimica degli esseri viventi?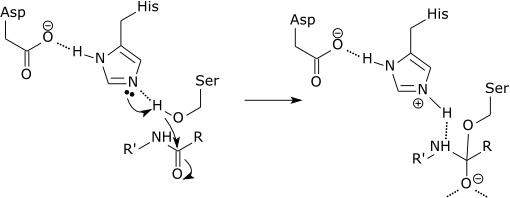 Schema grafico dell'azione di una proteasi che sta rompendo un collegamento peptidico nell'amminoacido dell'istidina (Fonte: Zephyris alla lingua inglese Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/)] via Wikimedia Commons)
Schema grafico dell'azione di una proteasi che sta rompendo un collegamento peptidico nell'amminoacido dell'istidina (Fonte: Zephyris alla lingua inglese Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/)] via Wikimedia Commons) Questi enzimi tagliano peptidi e proteine in modo non specifico. Tuttavia, tutti i peptidi e le proteine da tagliare devono essere legati dall'estremità N-terminale del collegamento peptidico al sito attivo dell'enzima.
Ogni breve proteasi è accuratamente il legame Amida che si forma tra l'estremità C-terminale dell'amminoacido nell'estremità carbossilica e l'ammina di acido amineo che si trova verso l'estremità N-terminale del peptide.
Fosfatasi nucleasi
Questi enzimi catalogo. Esistono molti tipi diversi di questi enzimi, poiché sono specifici per il tipo di acido nucleico e il sito di taglio.
 Schema grafico dell'azione di un endonucleasi idrolizzato un legame fosfoditester (fonte: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Schema grafico dell'azione di un endonucleasi idrolizzato un legame fosfoditester (fonte: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) Le endonucleasi sono indispensabili nel campo della biotecnologia, poiché consentono agli scienziati di modificare i genomi degli organismi tagliando e sostituendo i frammenti genetici di quasi tutte le cellule.
Le endonucleasi fanno il taglio delle basi azotate in tre fasi. Il primo è attraverso un aminoacido nucleofilo, quindi si forma una struttura intermedia con carico negativo che attira il gruppo fosfato e infine rompe il legame tra le due basi.
Riferimenti
- Davies, g., & Henrissat, B. (1995). Strutture e meccanismi di glicosil idrola. Struttura, 3 (9), 853-859.
- Lechinger, a. L., Nelson, d. L., Cox, m. M., & Cox, m. M. (2005). Principi di biochimica Lechinger. Macmillan.
- Mathews, a. P. (1936). Principi di biochimica. W. Legna.
- Murray, r. K., Granner, d. K., Mayes, p., & Rodwell, V. (2009). Biochimica illustrata di Harper. 28 (p. 588). New York: McGraw-Hill.
- Ollis, d. L., Cheeah, e., Cygler, m., Dijkstra, b., FOLOW, f., Franken, s. M.,... & Sussman, J. L. (1992). La piega α/β idrolasi. Proteina ingegneristica, progettazione e selezione, 5 (3), 197-211.

