Idrogenazione catalitica
- 4106
- 706
- Baldassarre Ross
 L'idrogenazione catalitica è una reazione chimica in cui il risultato finale è l'aggiunta di idrogeno a un altro composto. Fonte: Gabriel Bolívar
L'idrogenazione catalitica è una reazione chimica in cui il risultato finale è l'aggiunta di idrogeno a un altro composto. Fonte: Gabriel Bolívar Cos'è l'idrogenazione catalitica?
IL idrogenazione catalitica È la reazione chimica con cui l'idrogeno molecolare viene aggiunto in un composto a velocità più elevate.
La molecula H2 Non solo deve prima rompere il suo legame covalente, ma anche essere collisioni così piccole ed efficienti tra di esso e il composto da dove verrà aggiunto è meno probabile.
Il composto del recettore dell'idrogeno può essere organico o inorganico. Nei composti organici sono dove ci sono la maggior parte degli esempi di idrogenazione catalitica, in particolare quelli che hanno attività farmacologica, o hanno metalli incorporati nelle loro strutture (composti organometallici).
Quando viene aggiunto h2 A una struttura piena di carbonio, ciò che accade è che la sua insaturazione diminuisce, cioè il carbonio raggiunge il massimo grado di semplici collegamenti che può formare.
Pertanto, h2 Vengono aggiunti collegamenti doppi (c = c) e tripli (cricate), sebbene possano essere aggiunti anche ai gruppi di carbonil (c = O).
Pertanto, gli alcheni e le alcine reagiscono mediante idrogenazione catalitica. Analizzando superficialmente qualsiasi struttura, si può prevedere se aggiungerà o meno H2 Basta rilevare collegamenti doppi e tripli.
Caratteristiche dell'idrogenazione catalitica
L'immagine mostra il meccanismo di questa reazione. Tuttavia, è necessario affrontare alcuni aspetti teorici prima di descriverlo.
Le superfici delle sfere grigie rappresentano gli atomi di metallo che, come si vedranno, sono i catalizzatori dell'idrogenazione per eccellenza.
Rotture di legame idrogeno
- L'idrogenazione è una reazione esotermica, cioè rilascia calore a seguito della formazione di composti di energia inferiore.
Può servirti: acetanilide (c8h9no)- I legami C-H formati sono stabili, che richiedono una maggiore energia per la rottura successiva rispetto al legame H-H delle esigenze di idrogeno molecolare.
- L'idrogenazione comporta sempre prima la rottura del collegamento H-H. Questa rottura può essere omolitica, come in molti casi:
H-H => H ∙ + ∙ H
O eterolitico, che può essere somministrato, ad esempio, quando l'ossido di zinco è idrogeno, ZnO:
H-H => H+ + H-
- La differenza tra le due rotture sta nel modo in cui vengono distribuiti gli elettroni di collegamento. Se sono distribuiti allo stesso modo (covalentemente), ogni h finisce per trattenere un elettrone, mentre se la distribuzione è ionica, si termina senza elettroni, h+, E l'altro li vince completamente, h-.
- Entrambe le rotture sono possibili nell'idrogenazione catalitica, sebbene l'omolitico consenta di lasciare il posto allo sviluppo di un meccanismo logico per questo.
Sperimentale
- L'idrogeno è un gas, e quindi deve essere frizzante e garantire che solo lui predomina sulla superficie del liquido.
- Il composto idrogeno deve essere solubilizzato in un mezzo, che si tratti di acqua, alcool, etere, esteri o un'ammina liquida. Altrimenti, l'idrogenazione passerebbe molto lentamente.
Sciolto dal composto in idrogenare, deve esserci anche un catalizzatore nel mezzo di reazione. Ciò sarà responsabile dell'accelerazione della velocità della reazione.
- Nell'idrogenazione catalitica vengono solitamente usati metalli finemente divisi di nichel, paladio, platino o rodio, che sono insolubili in quasi tutti i solventi organici. Pertanto, ci saranno due fasi: un liquido con il composto disciolto e l'idrogeno, e un solido, quello del catalizzatore.
Può servirti: crociera per crogiolo: caratteristiche, funzioni, usa esempi- Questi metalli forniscono la loro superficie in modo che l'idrogeno e il composto reagiscano, in modo che le rotture del legame siano accelerate.
- Riducono anche lo spazio di diffusione della specie, aumentando il numero di collisioni molecolari efficaci. Non solo, ma anche la reazione avviene all'interno dei pori del metallo.
Tipi di idrogenazione catalitica
Omogeneo
Si parla di idrogenazione catalitica omogenea quando il mezzo di reazione è costituito da una singola fase. Qui l'uso dei metalli nei loro stati puri, poiché sono insolubili.
Invece, vengono utilizzati composti organometalici di questi metalli, che sono solubili e hanno dimostrato di avere rese elevate.
Uno di questi composti organometallici è il catalizzatore Wilkinson: Tris cloruro (trifenilfina) rodio, [(c6H5)3P]3RHCl.
Questi composti formano un complesso con H2, attivandolo per la sua successiva aggiunta all'Alkene o Alquino.
L'idrogenazione omogenea presenta molte più alternative che eterogenee, perché la chimica nei composti organometallici è abbondante: è sufficiente cambiare il metallo (Pt, PD, RH, NI) e i ligandi (le molecole organiche o inorganiche legate al centro metallico), a Ottieni un nuovo catalizzatore.
Eterogeneo
L'idrogenazione catalitica eterogenea, come appena accennato, ha due fasi: un liquido e uno solido.
Oltre ai catalizzatori metallici, ce ne sono altri che consistono in una miscela solida. Ad esempio, il catalizzatore Lindlar, composto da platino, carbonato di calcio, acetato di piombo e chinolina.
Il catalizzatore Lindlar ha la peculiarità che è scarsa per l'idrogenazione degli alcheni. Tuttavia, è molto utile per idrogenitazioni parziali, cioè funziona in modo eccellente sulle alcine:
Può servirti: Lutecio: struttura, proprietà, usi, ottenendoRC≡cr + H2 => Rhc = chr
Meccanismo
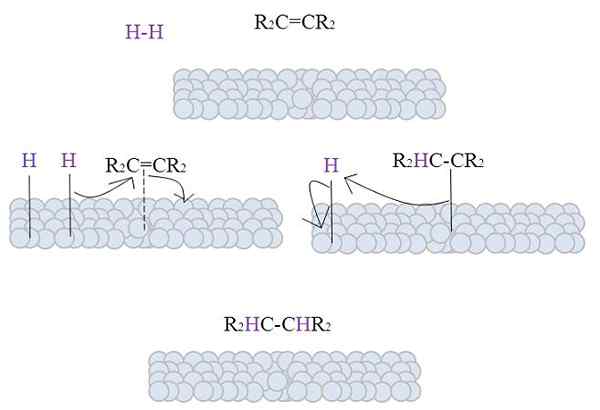
L'immagine mostra il meccanismo di idrogenazione catalitica usando un metallo in polvere come catalizzatore.
Le sfere grigie corrispondono alla superficie metallica di, per dire, platino. La molecola h2 (colore viola) è vicino alla superficie metallica, nonché al tetra alchene sostitutivo, R2C = cr2.
Il h2 Si verifica l'interazione con gli elettroni che percorrono gli atomi di metallo e si verificano una rottura e formazione di un collegamento temporale H-m, dove M è metallo. Questo processo è noto come Chemisorption. Cioè, un adsorbimento da parte delle forze chimiche.
L'Alkene interagisce in modo simile, ma il collegamento lo forma con il suo doppio legame (linea tratteggiata).
Il legame H-H si è già dissociato e ogni atomo di idrogeno rimane collegato al metallo. Allo stesso modo, lo fa con centri metallici nei catalizzatori organometallici, formando un complesso intermedio H-M-H.
Si verifica quindi una migrazione di una h verso il doppio legame e questo si apre formando un collegamento con il metallo. Quindi, la restante H si unisce all'altra carbonio dal doppio legame originale e l'alcane prodotto viene finalmente rilasciata, r2HC-CHR2.
Questo meccanismo verrà ripetuto tutte le volte necessarie, fino a tutti H2 hanno completamente reagito.
Riferimenti
- Carey, f. (2008). Chimica organica. Mc Graw Hill.
- Shiver & Atkins (2008). Chimica inorganica. Mc Graw Hill.
- Lew, J. (S.F.). Idrogenazione catalitica degli alcheni. Chimica recuperata.Librettexts.org
- Cos'è l'idrogenazione catalitica? - Meccanismo e reazione. Studio recuperato.com

