Idrolisi cosa consiste e esempi di reazioni
- 2949
- 218
- Enzo De Angelis
IL idrolisi È una reazione chimica che può verificarsi in molecole o ioni organici inorganici e che comporta la partecipazione dell'acqua per la rottura dei suoi legami. Il suo nome proviene dal greco, "idro" e "lisi" di rottura.
La molecola d'acqua, h2Oppure, stabilisce un equilibrio con gli ioni di sali acidi e basi deboli, che appare per la prima volta questo concetto in studi generali di chimica e in chimica analitica. È quindi una delle reazioni chimiche più semplici.
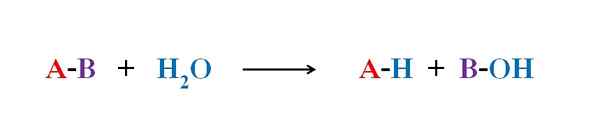 Equazione generale per una reazione di idrolisi. Fonte: Gabriel Bolívar.
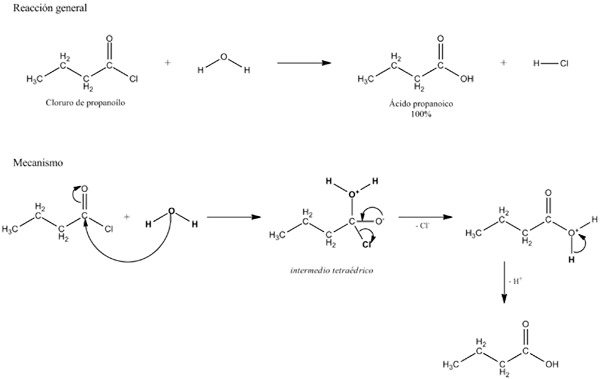
Equazione generale per una reazione di idrolisi. Fonte: Gabriel Bolívar. In diversi esempi di idrolisi, l'acqua da sola non è in grado di rompere un certo legame covalente. Quando ciò si verifica, il processo accelera o catalizza mediante acidificazione o alcalizzazione del mezzo; cioè, in presenza di ioni H3O+ o oh-, rispettivamente. Ci sono anche enzimi che catalizzano l'idrolisi.
L'idrolisi occupa un luogo speciale in termini di biomolecole, poiché i collegamenti che tengono uniti i loro monomeri sono suscettibili all'idrolizzato in determinate condizioni. Ad esempio, gli zuccheri vengono idrolizzati per decomporre i polisaccaridi nei loro monosaccaridi costituenti grazie all'azione degli enzimi glucosidasi.
[TOC]
Cos'è l'idrolisi?
L'immagine superiore spiega cosa consiste l'idrolisi. Si noti che non solo la molecola o il substrato (se mediano gli enzimi) rompe il loro collegamento, ma anche l'acqua stessa, che è "frattura" in H+ e oh-, Dove h+ termina con un e oh- con b. A-B reagisce con una molecola d'acqua che origina due prodotti, A-H e B-OH.
L'idrolisi è quindi la reazione contraria alla condensa. Nella condensa due prodotti, per dire a-H e b-oh, sono legati al rilascio di una piccola molecola: acqua. Nell'idrolisi viene consumata una molecola, mentre in condensa viene rilasciata o prodotta.
Può servirti: gruppo carbonile: caratteristiche, proprietà, nomenclatura, reattivitàTornando all'esempio degli zuccheri, supponiamo che A-B corrisponda a un dimero di saccarosio, dove rappresenta il glucosio e b fruttosio. Il collegamento glucosidico A-B può idrolizzarsi per originare i due monosaccaridi separatamente e in soluzione, e lo stesso accade a oligo e polisaccaridi se mediano gli enzimi in tali reazioni.
Si noti che in questa reazione, quella di A-B, la freccia ha un solo indirizzo; Cioè, è un'idrolisi irreversibile. Tuttavia, molte idrolisi sono in realtà reazioni reversibili che raggiungono un equilibrio.
Esempi di reazioni di idrolisi
- ATP
L'ATP è stabile tra valori di pH di 6,8 e 7,4. Tuttavia, a valori di pH estremi è spontaneamente idrolizzato. Negli esseri viventi, l'idrolisi è catalizzata da enzimi noti come Atasas:
ATP +H2O => ADP +pi
Questa reazione è fortemente esergonica, poiché l'entropia di ADP è maggiore di quella dell'ATP. La variazione di energia libera di Gibbs (ΔGº) è - 30,5 kJ/mol. L'energia prodotta dall'idrolisi ATP viene utilizzata in numerose reazioni di Endergon.
Reazioni accoppiate
In alcuni casi, l'idrolisi ATP viene utilizzata per la conversione di un composto in un composto (B).
A +ATP +H2O B +ADP +PI +H+
- Acqua
Due molecole d'acqua possono reagire tra loro in un'apparente idrolisi:
H2O + h2O h3O+ + OH-
È come se una di quelle molecole d'acqua fratturata in h+ e oh-, Andare a collegare l'H+ All'atomo di ossigeno dell'altra molecola d'acqua, che causa lo ione idroelescenziale, h3O+. Questa reazione, più dell'idrolisi, riguarda l'auto -propotelisi dell'acqua.
Può servirti: energia di attivazione- Proteine
Le proteine sono macromolecole stabili e per raggiungere la loro idrolisi completa, negli aminoacidi che le costituiscono, sono necessarie condizioni estreme; come una concentrazione di acido cloridrico (6 m) e alte temperature.
Tuttavia, gli esseri viventi sono dotati di un arsenale enzimatico che consente l'idrolisi delle proteine negli aminoacidi nel duodeno. Gli enzimi coinvolti nella digestione delle proteine sono quasi completamente secreti dal pancreas.
Esistono enzimi esopeptidasi che degradano le proteine, a partire dalle loro estremità: aminopeptidasi attraverso l'estremità amminica e carbossipeptidasi attraverso l'estremità carbossilica. Gli enzimi endopeptidasi esercitano la loro azione all'interno della catena proteica, ad esempio: Tripsin, Pepsin, Chimotripsin, ecc.
- Amidas ed esteri
Le ammidi quando riscaldate in un mezzo alcalino hanno origine un acido carbossilico e un'ammina:
Rconh2 + H2O => rcoo- + NH2
Abeats in un mezzo acquoso sono idrolizzati in acido carbossilico e alcool. Il processo è catalizzato da una base o da un acido:
Rco-or ' +h2O => rcooh +r'oh
Questa è la famosa reazione di saponificazione.
- Acido base
Nell'acqua diverse specie vengono idrolizzate per acidificare o alcalizzare l'ambiente acquoso.
Aggiunta di un sale di base
Acetato di sodio, un sale di base, dissocia in acqua che dà ioni Na+ (sodio) e Cho3COO- (acetato). La sua basicità è perché l'acetato è idrolizzato per generare ioni oh-, Mentre il sodio rimane invariato:
Cap3COO- + H2O ch3COOH +OH-
Può servirti: metil salicilatoOH- È responsabile del pH per aumentare e diventare fondamentale.
Aggiunta di un sale acido
Cloruro di ammonio (NH4Cl) è formato dallo ione cloruro (Cl-) dall'acido cloridrico (HCl), un forte acido e il catione di ammonio (NH4+) dall'idrossido di ammonio (NH4Oh), una base debole. Il cl- Non si dissocia in acqua, ma il catione di ammonio viene trasformato in acqua nel modo seguente:
NH4+ + H2O nh3 + H3O+
L'idrolisi del catione di ammonio produce protoni che aumentano l'acidità di un mezzo acquoso, quindi si è concluso che l'NH4CL è un sale acido.
Aggiunta di un sale neutro
Il cloruro di sodio (NaCl) è un prodotto salino della reazione di una base forte (NaOH) con un forte acido (HCL). Quando si dissolve il cloruro di sodio nell'acqua, viene prodotto il catione di sodio (NA+) e l'anione (cl-). Entrambi gli ioni non si dissociano nell'acqua, quindi non aggiungono h+ o oh-, Mantenere costante il tuo pH.
Pertanto, si dice che il cloruro di sodio sia un sale neutro.
Riferimenti
- Mathews, c. K., Van Holde, K. E. E Ahern, K. G. (2002). Biochimica. (Terza edizione). Modificare. Pearson-Addison Wesley.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Helmestine, Anne Marie, PH.D. (13 gennaio 2019). Idrolisi: definizione ed esempio. Recuperato da: Thoughtco.com
- Theresa Phillips. (28 aprile 2019). Una spiegazione del processo di idrolisi. Recuperato da: thebelance.com
- I redattori di Enyclopedia Britannica. (16 novembre 2016). Idrolisi. Encyclopædia Britannica. Recuperato da: Britannica.com
- Wikipedia. (2019). Idrolisi. Recuperato da: in.Wikipedia.org
- « Caratteristiche di Hyracotherium, nutrizione, specie, riproduzione
- History of Origins videogiochi alla realtà virtuale »

