Storia di elio, proprietà, struttura, rischi, usi

- 1605
- 413
- Silvano Montanari
Lui elio È un elemento chimico il cui simbolo è. Questo è il primo gas nobile nella tavola periodica e di solito si trova alla fine dello stesso. In condizioni normali è un gas inerte, poiché nessuno dei suoi pochi composti è stabile; Si espande anche molto rapidamente ed è la sostanza con il minimo punto di ebollizione di tutti.
A livello popolare è un gas ben noto, poiché in innumerevoli eventi o feste per bambini è comune. Tuttavia, ciò che veramente e per sempre si perde verso gli angoli del sistema solare e oltre, sono gli atomi di elio che vengono rilasciati una volta che il globo è stato scomposto.
 Palloncini gonfiati con elio, il più vicino che può essere di questo elemento in situazioni quotidiane. Fonte: Pixabay.
Palloncini gonfiati con elio, il più vicino che può essere di questo elemento in situazioni quotidiane. Fonte: Pixabay. In effetti, ci sono quelli che, e con grande ragione, credono che i palloncini di elio rappresentino una pratica inappropriata per questo gas. Fortunatamente, ha usi più importanti e interessanti, grazie alle sue proprietà fisiche e chimiche che lo separano da altri elementi chimici.
Ad esempio, l'elio liquido è così freddo che può congelare qualsiasi cosa, come lega di metallo, rendendolo un materiale superconduttore. È anche un liquido che manifesta la superfluidità, in grado di scalare le pareti di un contenitore di vetro.
Il suo nome è perché è stato identificato per la prima volta al sole e non sulla terra. È il secondo elemento più abbondante dell'intero universo e, sebbene la sua concentrazione sia ridicola nella crosta terrestre, può essere ottenuto dalle riserve di gas naturale e minerali radioattivi di uranio e torio.
Qui l'elio dimostra un altro fatto curioso: è un gas che abbonda molto più nel sottosuolo che nell'atmosfera, dove finisce per fuggire dalla terra e il suo campo gravitazionale.
[TOC]
Storia
L'elio non è stato scoperto sulla terra ma al sole. In effetti, il suo nome viene dalla parola greca "Helios" che significa sole. L'esistenza dell'elemento da sola contrastava la tavola periodica di Dmitri Mendeléyev, perché non c'era posto per un nuovo gas; Cioè, ormai non c'era assolutamente nulla sui gas nobili.
Il nome "Helio", scritto come "elio" in inglese, si è concluso con il suffisso -ium riferendosi ad esso come un metallo; Proprio perché l'esistenza di un altro gas a parte l'ossigeno, l'idrogeno, il fluoro, il cloro e l'azoto non potevano essere ammessi.
Questo nome è stato designato dall'astronomo inglese Norman Lockyer, che ha studiato dall'Inghilterra ciò che è stato osservato da French Astronom.
Fino ad allora era una linea spettrale gialla di un elemento sconosciuto. Lockyer ha detto che ciò era dovuto alla presenza di un nuovo elemento chimico trovato al sole.
Nel 1895, quasi vent'anni dopo, il chimico scozzese Sir William Ramsay riconobbe lo stesso spettro da un gas rimanente quando studiava un minerale radioattivo: Cleveíta. C'era quindi anche Helio qui.
Proprietà fisiche e chimiche
Aspetto
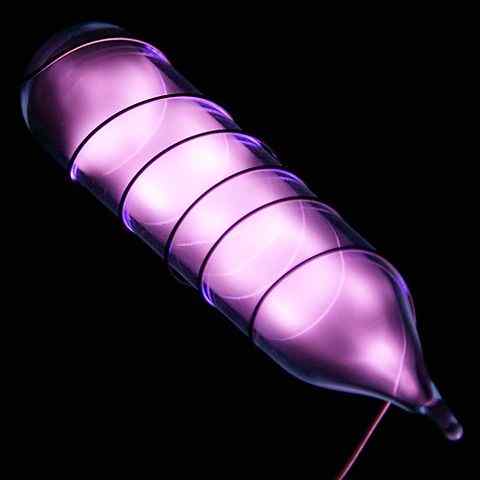 Ampoule con un campione di elio che brilla dopo una scossa elettrica. Fonte: immagini ad alta risoluzione di elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
Ampoule con un campione di elio che brilla dopo una scossa elettrica. Fonte: immagini ad alta risoluzione di elementi chimici [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] L'elio è un gas incolore e inodore, che non ha sapore ed è anche inerte. Tuttavia, quando viene applicata una scossa elettrica e, a seconda della differenza di tensione, inizia a brillare come una nebbia morale grigiastra (immagine superiore), per poi brillare con un bagliore arancione. Pertanto, le luci dell'elio sono arancioni.
Numero atomico (Z)
2
Massa molare
4,002 g/mol
Punto di fusione
-272,2 ºC
Punto di ebollizione
-268,92 ºC
Densità
-0,1786 g/L, in condizioni normali, cioè in una fase gassosa.
-0,145 g/ml, nel punto di fusione, l'elio liquido.
-0,125 g/ml, proprio quando l'elio inizia a bollire.
-0,187 g/ml, a 0 k e 25 atm, cioè elio solido a quelle specifiche condizioni di pressione e temperatura.
Triplo punto
2.177 K e 5.043 kPa (0,04935 atm)
Punto critico
5.1953 K e 0,22746 MPa (2.2448 atm)
Calore di fusione
0,0138 kJ/mol
Calore di vaporizzazione
0,0829 kJ/mol
Capacità termica molare
20,78 J/(mol · K)
Pressione del vapore
0.9869 ATM a 4,21 K. Questo valore serve a dare un'idea di come la flotta.
Energie di ionizzazione
-Primo: 2372,3 kj/mol (lui+ gassoso)
-Secondo: 5250,5 kJ/mol (lui2+ gassoso)
Le energie di ionizzazione per l'elio sono particolarmente elevate perché l'atomo del gas deve perdere un elettrone, che sperimenta un forte carico nucleare efficace. Si può anche comprendere se viene considerata la dimensione ridotta dell'atomo e come "vicini" sono i due elettroni rispetto al nucleo (con i loro due protoni e due neutroni).
Solubilità
Nell'acqua, 0,97 ml vengono sciolti per 100 ml di acqua a 0 ºC, il che significa che è poco solubile.
Può servirti: ossalato di ammonioReattività
L'elio è il secondo elemento chimico meno reattivo in natura. In condizioni normali ha successo affermare che si tratta di un gas inerte; Mai (per quello che sembra) può essere manipolato un composto di elio in una stanza o in laboratorio senza enormi pressioni che agiscono su di esso; O forse, temperature drammaticamente alte o basse.
Un esempio che vediamo nel composto Na2Lui, che è stabile solo sotto una pressione di 300 GPa, è riprodotto in una cellula di diamante yunque.
Mentre i legami chimici nel NA2Avere "estranei" per avere i loro elettroni ben posizionati nei cristalli, sono tutt'altro che semplici interazioni di van der Walls e, quindi, non è semplicemente costituito da atomi di elio intrappolati da aggregati molecolari. È qui che il dilemma tra cui i composti di elio sono reali e che no.
Ad esempio, le molecole di azoto ad alte pressioni possono imprigionare un atomo di elio per causare un tipo di rumore2)undici.
Inoltre, ci sono complessi di endo di endo60+N e C70+N, nelle cui cavità possono ospitare atomi di elio; e il catione molecolare eh+ (He-h+), trovato in nebulose molto lontane.
Numero di ossidazione
Che per curiosità cerca di calcolare il numero di ossidazione per l'elio in uno qualsiasi dei suoi composti scoprirà che ciò è uguale a 0. Nel na2Lui, per esempio, si potrebbe pensare che la sua formula corrisponda a ioni ioni ipotetici2+Lui2-; Ma tale sarebbe quello di supporre che abbia un carattere ionico puro, quando in realtà i suoi legami sono lungi dall'essere.
Inoltre, l'elio non vince elettroni perché non può ospitarli nell'energia orbitale e non disponibile; E nemmeno è possibile perderli, a causa delle dimensioni ridotte del suo atomo e della grande carico nucleare efficace del suo nucleo. Ecco perché l'elio partecipa sempre (in teoria) come atomo0 Nei suoi composti derivati.
Struttura elettronica e configurazione
L'elio, come tutti i gas osservati in una macroescala, occupa il volume dei contenitori che lo memorizza, avendo così un modo indefinito. Tuttavia, quando la temperatura scende e inizia a raffreddare al di sotto di -269 ºC, il gas si condensa in un liquido incolore; L'elio I, il primo delle due fasi liquide per questo elemento.
Il motivo per cui l'elio si condensa a una temperatura così bassa è dovuto alle poche forze di dispersione che tengono insieme i loro atomi; Qualunque sia la fase considerata. Questo può essere spiegato dalla sua configurazione elettronica:
1s2
In cui due elettroni occupano l'orbitale atomico 1S. L'atomo di elio può essere visualizzato come una sfera quasi perfetta, la cui periferia elettronica omogenea non è molto inclini a polarizzare dall'efficace carico nucleare dei due protoni nel nucleo.
Pertanto, i momenti di dipolo spontanei e indotti sono rari e molto deboli; Quindi la temperatura deve avvicinarsi allo zero assoluto in modo che gli atomi si siano avvicinati a una lentezza sufficiente e facciano definire le loro forze dispersive; O ancora meglio, un bicchiere di elio.
Dimeri
Nella fase gassosa lo spazio che separa gli atomi ha tale da presumere che uno degli altri sia sempre separato. Tanto che in una vescica, di poco volume, l'elio sembra incolore fino a quando non è sottoposto a una scossa elettrica, che ionizza i suoi atomi in una nebbia grigiastra e piccola luminosa.
Tuttavia, nella fase liquida che gli atomi hanno, anche con le loro interazioni deboli, non possono più "ignorare" per un tempo più lungo. Ora la forza di dispersione lo consente2. Pertanto, puoi pensare all'elio I come vasti gruppi di lui2 in equilibrio con i suoi atomi di fase del vapore.
Ecco perché l'elio i è così difficile da differenziare dai suoi vapori. Se questo liquido viene versato fuori dal suo contenitore ermetico, fugge come un bagliore biancastro.
Helio II
Quando la temperatura scende ancora di più, toccando i 2.178 K (-270.972 ºC), si verifica una transizione di fase: l'elio I viene trasformato in elio II.
Da questo punto, l'affascinante fluido elio diventa un fluido superfluo o quantistico; cioè, le sue proprietà macroscopiche si manifestano come se i dimeri2 Erano atomi individuali (e forse lo sono). Manca la completa viscosità, perché non vi è alcuna superficie che possa fermare un atomo durante la sua scorrimento o "arrampicata".
Ecco perché Helio II può sollevarsi attraverso le pareti di un contenitore di vetro che supera la forza di gravità; Indipendentemente da quanto siano alti, fintanto che la superficie rimane alla stessa temperatura e, quindi, non volatizza.
Può servirti: acido pituitario (H3PO2): proprietà, usi e reagentiPer questo motivo, l'elio liquido non può essere immagazzinato in contenitori di vetro, poiché fuggirebbe prima del minimo fessura o scappatoia; Molto simile a come accadrebbe con un gas. Invece, l'acciaio inossidabile viene utilizzato per progettare questi contenitori (serbatoi Dewars).
Cristalli
Sebbene la temperatura discese fino a 0 K (lo zero assoluto), la forza di dispersione tra gli atomi non sarebbe abbastanza forte da ordinarli in una struttura cristallina. Per effettuare la solidificazione, la pressione deve aumentare a circa 25 atm; E poi, appaiono cristalli esagonali compatti (HCP).
Gli studi geofisici dimostrano che questa struttura di HCP rimane invariata di gran lunga che la pressione è aumentata (fino all'ordine del Pascal giga, GPA). Tuttavia, c'è una regione stretta nel suo diagramma a temperatura di pressione in cui questi cristalli HCP subiscono una transizione verso una fase cubica centrata sul corpo (BCC).
Dov'è e ottieni
Cosmos e rocce
 L'elio rappresenta il secondo elemento più abbondante dell'universo e il 24% della sua massa. Fonte: pxhere.
L'elio rappresenta il secondo elemento più abbondante dell'universo e il 24% della sua massa. Fonte: pxhere. L'elio è il secondo elemento più abbondante in tutto l'universo, superato solo dall'idrogeno. Le stelle producono costantemente quantità incommensurabili di atomi di elio mescolando due nuclei di idrogeno durante il processo di nucleosintesi.
Allo stesso modo, qualsiasi processo radioattivo che emette particelle α è una fonte di produzione di atomi di elio se interagiscono con gli elettroni dell'ambiente; Ad esempio, con quelli di un corpo roccioso in carri armati di minerali radioattivi di uranio e torio. Questi due elementi soffrono di decadimento radioattivo, a partire dall'uranio:
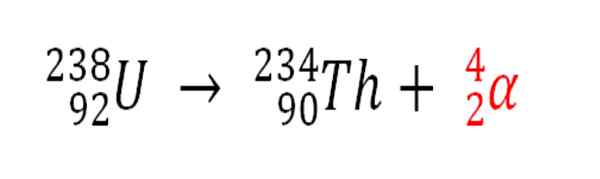 Decadimento radioattivo nell'uranio nella formazione di particelle di alfas, che successivamente si trasformano in atomo di elio in depositi sotterranei. Fonte: Gabriel Bolívar.
Decadimento radioattivo nell'uranio nella formazione di particelle di alfas, che successivamente si trasformano in atomo di elio in depositi sotterranei. Fonte: Gabriel Bolívar. Pertanto, nelle rocce in cui questi minerali radioattivi sono concentrati, gli atomi di elio saranno intrappolati, che verranno rilasciati una volta digeriti in media acidi.
Tra alcuni di questi minerali ci sono Cleveíta, Carnotita e Uraninite, tutti composti da ossidi di uranio (UO2 o u3O8) e impurità di torio, metalli pesanti e terre rare. L'elio, irrigato attraverso i canali sotterranei, può finire per accumularsi in serbatoi di gas naturale, molle minerali o in ferri meteorici.
Si stima che una massa di elio equivale a 3000 tonnellate sia prodotta ogni anno, dal decadimento radioattivo di uranio e torio.
Aria e mari
L'elio non è molto solubile nell'acqua, quindi prima piuttosto che dopo finisce per salire dalle profondità (dove viene trovata la sua origine), per attraversare gli strati dell'atmosfera e infine raggiungere lo spazio siderale. I suoi atomi sono così piccoli e leggeri che il campo gravitazionale della terra non può trattenerli nell'atmosfera.
A causa di quanto sopra, la concentrazione di elio sia nell'aria (5,2 ppm) che nei mari (4 ppt) è molto bassa.
Se volessi estrarre da uno di quei due media, l'opzione "migliore" sarebbe l'aria, che dovrebbe prima presentarla alla liquefazione per condensare tutti i gas componenti, mentre l'elio rimane in uno stato gassoso.
Tuttavia, non è pratico ottenere elio dall'aria, ma dalle rocce arricchite con minerali radioattivi; o meglio ancora, delle riserve di gas naturale, dove l'elio può rappresentare fino al 7% della sua massa totale.
Liquefazione e distillazione del gas naturale
Invece di sottoporre l'aria, è più facile e più redditizio. Pertanto, la materia prima per l'eccellenza (commerciale) per ottenere l'elio è il gas naturale, che può anche essere sottoposto a distillazione frazionaria.
Il prodotto finale della distillazione è finito per purificare con carbonio attivo, che passa attraverso una grande purezza elio. E infine, l'elio si separa dal neon attraverso un processo criogenico in cui viene utilizzato l'elio liquido.
Isotopi
L'elio è presentato in natura prevalentemente come isotopo 4Lui, il cui nucleo nudo è la famosa particella α. Questo atomo di 4Ho due neutroni e due protoni. In minore abbondanza è l'isotopo 3Lui, che ha un solo neutrone. Il primo è più pesante (ha una massa atomica maggiore) del secondo.
Quindi, la coppia di isotopi 3Lui e 4Sono quelli che definiscono le proprietà mesurabili e ciò che comprendiamo dell'elio come elemento chimico. Dal 3È più leggero, si presume che i loro atomi abbiano più energia cinetica e che, quindi, abbiano bisogno di una temperatura ancora inferiore a coeso in un superfluo.
Lui 3Ho considerato una specie molto rara qui sulla terra; Tuttavia, nei terreni lunari è più abbondante (circa 2000 volte). Ecco perché la luna è stata soggetta a progetti e storie come possibile fonte di 3Lui, che potrebbe essere usato come combustibile nucleare per il veicolo spaziale del futuro.
Può servirti: sostanze pureTra gli altri isotopi di elio possono essere menzionati, con i rispettivi tempi di mezza vita: 5LUI (T1/2= 7,6 · 10−22 S), 6LUI (T1/2= 0,8 s) e 8LUI (T1/2= 0,119 s).
Rischi
L'elio è un gas inerte e, quindi, non partecipa a nessuna delle reazioni che si verificano all'interno dei nostri corpi.
I suoi atomi praticamente entrano e vengono espirati senza le loro interazioni con le biomolecole che producono un effetto successivo; Tranne il suono emesso dalle corde vocali, che diventano più acute e hanno più frequenza.
Le persone che inalano l'elio di un pallone (con moderazione), parlano con una voce acuta, simile a quella di uno scoiattolo (o anatra).
Il problema sta nel fatto che se detto persona inalesse una quantità inappropriata di elio, il rischio di corse soffocanti, poiché i loro atomi si spostano alle molecole di ossigeno; E quindi, non sarà in grado di respirare fino a quando tutto ciò che elio espira, che a sua volta a causa della sua pressione può strappare il tessuto polmonare o causare barotrauma.
Casi di persone che sono morte per inalazione Helio sono stati segnalati a causa dei nuovi spiegati.
D'altra parte, sebbene non rappresenti un rischio di incendio data la sua mancanza di reattività nei confronti dell'ossigeno (o di altra sostanza), se è immagazzinata sotto elevate pressioni e fughe, la sua fuga può essere fisicamente pericolosa.
Applicazioni
Le proprietà fisiche e chimiche di Helio non solo lo rendono un gas speciale, ma anche una sostanza molto utile per le applicazioni che meritano le temperature in modo estremamente basso. In questa sezione verranno affrontate alcune di queste applicazioni o usi.
Sistemi di pressione e spurgo
In alcuni sistemi è necessario aumentare la pressione (pressurizzare) e per questo deve essere iniettato o fornire che non interagisce con nessuno dei suoi componenti; Ad esempio, con reagenti o superfici sensibili alle reazioni indesiderabili.
Pertanto, la pressione può essere aumentata con i volumi di elio, la cui inerzia chimica lo rende ideale a questo scopo. L'atmosfera inerta che facilita supera in alcuni casi di azoto.
Per il processo inverso, cioè lo spurgo, l'elio viene utilizzato anche a causa della sua capacità di trascinare tutto l'ossigeno, i vapori idrici o qualsiasi altro gas, la cui presenza desidera eliminare. In questo modo la pressione del sistema viene ridotta una volta che l'elio è stato svuotato.
Rilevamenti di perdite
L'elio può essere filtrato attraverso il minimo fessura, quindi serve anche a rilevare perdite in tubi, contenitori ad alto valore o serbatoi criogenici.
A volte il rilevamento può essere effettuato visivamente o tramite tatto; Tuttavia, principalmente un rivelatore è ciò che "lancia" il segnale di dove e quanto elio sta sfuggendo al sistema sotto ispezione.
Drag Gas
Gli atomi di elio, come menzionato per i sistemi di spurgo, possono trascinarlo, a seconda della pressione, molecole più pesanti. Ad esempio, questo principio viene utilizzato quotidianamente nell'analisi della gascromatografia, poiché può trascinare il campione atomizzato lungo la colonna, dove interagisce con la fase stazionaria.
Palloncini e dirigibili
 L'elio è usato per gonfiare i dirigibili ed è molto più sicuro dell'idrogeno perché non è un gas infiammabile. Fonte: Pixabay.
L'elio è usato per gonfiare i dirigibili ed è molto più sicuro dell'idrogeno perché non è un gas infiammabile. Fonte: Pixabay. A causa della sua bassa densità rispetto all'aria e, ancora una volta, alla sua mancanza di reattività con ossigeno, è stato usato per gonfiare i palloncini alle feste per bambini (miscelato con ossigeno in modo che nessuno sia soffocato per la respirazione) e ai dirigibili (immagine superiore) , senza essere in grado di rappresentare un rischio di incendio.
Tuffo
 L'elio è uno dei componenti principali dei serbatoi di ossigeno con cui i subacquei respirano. Fonte: pxhere.
L'elio è uno dei componenti principali dei serbatoi di ossigeno con cui i subacquei respirano. Fonte: pxhere. Quando i subacquei scendono a maggiori profondità, trovano difficile respirare a causa della grande pressione esercitata dall'acqua. Ecco perché Helio viene aggiunto nei suoi serbatoi di ossigeno per ridurre la densità del gas che i subacquei respirano ed espirano, e quindi può essere espirato con meno lavoro.
Saldatura ad arco
Nel processo di saldatura, l'arco elettrico porta abbastanza calore in modo che i due metalli siano uniti. Se eseguito sotto un'atmosfera di elio, il metallo a incandescenza non reagirà con l'ossigeno dell'aria per diventare il suo rispettivo ossido; Pertanto, l'elio impedisce che ciò accada.
Superconduttori
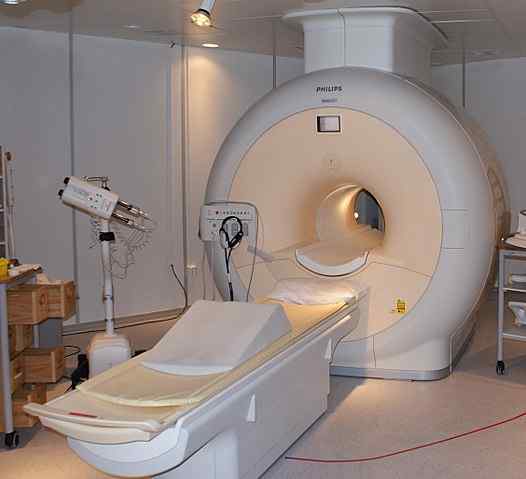 L'elio liquido viene utilizzato per refrigerare i magneti utilizzati negli scanner di risonanza magnetica nucleare. Fonte: Jan Ainali [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]
L'elio liquido viene utilizzato per refrigerare i magneti utilizzati negli scanner di risonanza magnetica nucleare. Fonte: Jan Ainali [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] L'elio liquido è così freddo che può congelare i metalli per trasformarli in superconduttori. Grazie a ciò, sono stati fabbricati magneti molto potenti, che, refrigerati con elio liquido, sono stati usati in immagini di immagini o spettrometri di risonanza magnetica nucleare.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Andy Estance. (17 aprile 2019). Ione idruro di elio rilevato nello spazio per la prima volta: prove trovate per la chimica sfuggente dai primi minuti dell'universo. Recuperato da: Chemistryworld.com
- Peter Wothers. (19 agosto 2009). Elio. Chimica nel suo elemento. Recuperato da: Chemistryworld.com
- Wikipedia. (2019). Elio. Recuperato da: in.Wikipedia.org
- Mao, h. K., Wu, e., Jephcoat, a. P., Hemley, r. J., Bell, p. M., & Bassett, W. A. (1988). Struttura cristallina e densità di elio fino a 232 kbar. Estratto da: articoli.ADSABS.Harvard.Edu
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Elio. Database PubChem. CID = 23987. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Mary-Ann Muffeletto. (6 febbraio 2017). Su, su e fuori: i chimici dicono "Sì", l'elio può formare composti. Utah State University. Recuperato da: Phys.org
- Steve Gagnon. (S.F.). Isotopi dell'elemento elio. Jefferson Lab. Recuperato da: istruzione.Jlab.org
- Advameg, inc. (2019). Elio. Recuperato da: chimica esplicata.com
- « Bottiglia di parti di Leyden, operazione, esperimenti
- Più background, contenuti, conseguenze, conseguenze »

