Caratteristiche del glutation, struttura, funzioni, biosintesi
- 3707
- 932
- Rufo Longo
Lui Glutation (GSH) È una piccola molecola tripeptidica (con solo tre rifiuti non proteici) che partecipa a molti fenomeni biologici come la meccanica enzimatica, la biosintesi delle macromolecole, il metabolismo intermedio, la tossicità dell'ossigeno, il trasporto intracellulare, ecc.
Questo piccolo peptide, presente negli animali, nelle piante e in alcuni batteri, è contemplato come "respingente" ossido -ductore, poiché è uno dei principali composti a basso peso molecolare che contiene zolfo e manca di tossicità associata ai residui di cisteina.
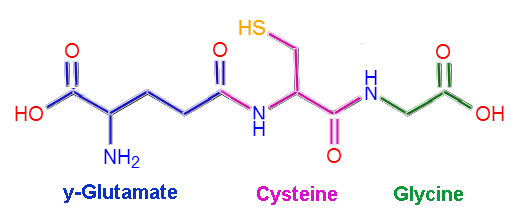
 Struttura molecolare del glutatione (Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons)
Struttura molecolare del glutatione (Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] via Wikimedia Commons) Alcune malattie nell'uomo sono state associate alla carenza di enzimi specifici del metabolismo del glutatione, e ciò è dovuto alle loro molteplici funzioni nel mantenimento dell'omeostasi del corpo.
La malnutrizione, lo stress ossidativo e altre patologie subite dagli esseri umani possono essere evidenziati come una drastica riduzione del glutatione, quindi a volte è un buon indicatore dello stato di salute dei sistemi corporei.
Per le piante, allo stesso modo, il glutatione è un fattore indispensabile per la sua crescita e sviluppo, poiché svolge anche le funzioni in più percorsi biosintetici ed è essenziale per la disintossicazione cellulare e l'omeostasi interna, dove agisce come un potente antiossidante.
[TOC]
Caratteristiche
I primi studi condotti in relazione alla posizione subcellulare del glutatione hanno dimostrato che è presente nei mitocondri. Successivamente, è stato osservato anche nella regione corrispondente alla matrice nucleare e nei perossisomi.
Al momento è noto che il compartimento in cui la sua concentrazione è più abbondante è in citosol, poiché è attivamente prodotto e trasportato in altri compartimenti cellulari come i mitocondri.
Nelle cellule dei mammiferi, la concentrazione di glutatione è nell'intervallo di millimoli, mentre nel plasma ematico la sua forma ridotta (GSH) si trova nelle concentrazioni micromolari.
Questa concentrazione intracellulare ricorda la concentrazione di glucosio, potassio e colesterolo, elementi indispensabili per la struttura cellulare e il metabolismo.
Alcuni organismi hanno molecole analogiche o varianti di glutatione. I parassiti protozoi che colpiscono i mammiferi hanno una forma nota come "tripanozione" e in alcuni batteri questo composto è sostituito da altre molecole solforzate come il tiosolfato e la glutamilcisteina.
Alcune specie di piante hanno, oltre al glutatione, molecole omologhe che hanno rifiuti diversi dalla glicina all'estremità C-terminale (omoglutazione) e che sono caratterizzate da funzioni simili a quelle del tripéptide in questione.
Nonostante l'esistenza di altri composti simili al glutatione in diversi organismi, questo è uno dei "tiolle" che è in maggiore concentrazione intracellulare.
L'alta relazione che esiste normalmente tra la forma ridotta (GSH) e la forma ossidata (GSSG) di glutation è un'altra caratteristica distintiva di questa molecola.
Struttura
Gutazione o L-German-Glutamil-cisteinil-glicina, come suggerisce il nome, è composto da tre rifiuti di aminoacidi: L-glutammato, L-cisteina e glicina. I residui di cisteina e glicina si legano tra loro attraverso collegamenti peptidici comuni, cioè tra il gruppo α-carbossilico di un aminoacido e il gruppo α-amino dell'altro.
Tuttavia, il legame tra glutammato e cisteina non è tipico della proteina, poiché si verifica tra la porzione γ-carbossilica del gruppo R del glutammato e il gruppo α-amino della cisteina, quindi questo collegamento è chiamato γ collegamento.
Questa piccola molecola ha una massa molare di poco più di 300 g/mol e la presenza del collegamento γ sembra essere cruciale per l'immunità di questo peptide contro l'azione di molti enzimi aminopeptidasi.
Può servirti: solidarietà tra specieFunzioni
Come accennato, il glutatione è una proteina che partecipa a numerosi processi cellulari di animali, piante e alcuni procarioti. In questo senso, la tua partecipazione generale può essere evidenziata in:
-Sintesi proteica e processi di degradazione
-La formazione di precursori ribonucleotidici del DNA
-La regolazione dell'attività di alcuni enzimi
-La protezione delle cellule in presenza di specie reattive dell'ossigeno (ROS) e altri radicali liberi
-Trasduzione del segnale
-Espressione genetica e in
-Apoptosi cellulare programmata o morte
Coenzima
È stato anche determinato che il glutatione funziona come coenzima in molte reazioni enzimatiche e che parte della sua importanza è correlata a ciò che ha la capacità di trasportare aminoacidi sotto forma di aminoacidi γ-glutamil.
Il glutation che può lasciare la cellula (che lo fa nella sua forma ridotta) è in grado di partecipare alle reazioni di riduzione dell'ossido in prossimità della membrana plasmatica e dell'ambiente cellulare circostante, che protegge le cellule di danno davanti a diversi tipi di agenti ossidanti.
Conservazione della cisteina
Questo tripéptido funziona anche come fonte di stoccaggio della cisteina e contribuisce al mantenimento dello stato ridotto dei gruppi di solfidhil di proteina all'interno del gruppo Hemo del gruppo Hemo delle proteine che contengono detto cofattore.
Piegatura proteica
Quando partecipa al ripiegamento delle proteine, sembra avere una funzione importante come agente riducente dei ponti disolfuro che sono stati formati in modo inappropriato nelle strutture proteiche, che di solito è dovuta all'esposizione ad agenti ossidanti come ossigeno, perossido di idrogeno, perossiniti e alcuni superossidi e alcuni superossidi.
Funzione negli eritrociti
Negli eritrociti, la ridotta glutatione (GSH) prodotta dall'enzima reduttasi glutation perossidasi, che produce acqua ossidata e glutatione (GSSG).
La decomposizione del perossido di idrogeno e, quindi, la prevenzione del suo accumulo negli eritrociti, prolunga il tempo di vita di queste cellule, poiché evita il danno ossidativo che può verificarsi nella membrana cellulare e che può terminare nell'emolisi.
Metabolismo xenobiotico
Il glutation è anche un importante protagonista nel metabolismo xenobiotico, grazie all'azione dell'enzima di glutatione S-trasference che generano coniugati di glutatione che possono quindi essere metabolizzati intracellulari.
È saggio.
Stato ossidativo delle cellule
Poiché esiste il glutatione in due forme, una ridotta e una ossidata, la relazione tra le due molecole determina lo stato redox delle cellule. Se il rapporto GSH/GSSG è maggiore di 100, le cellule sono considerate sane, ma se è vicino a 1 o 10, potrebbe essere un indicatore che le cellule sono in uno stato di stress ossidativo.
Biosintesi
La glutatia tripideide è sintetizzata all'interno cellulare, sia piante che animali, mediante l'azione di due enzimi: (1) la γ-glutamilcistina sintetasi e (2) la sintetasi glutatione (GSH sintetasi), mentre la sua degradazione o "decomposizione" dipende dall'azione dipende dall'azione dell'enzima γ-glutamil transpeptidasi.
Negli organismi vegetali, ciascuno degli enzimi è codificato da un singolo gene e difetti in una qualsiasi delle proteine o dei loro geni codificanti può causare la letalità negli embrioni.
Può servirti: filogenesiNell'essere umano, come in altri mammiferi, il sito principale di sintesi e esportazione di glutation.
Sintesi di novo di glutatione, la loro rigenerazione o riciclaggio, richiedono energia dall'ATP.
Glutatione ridotto (GSH)
Il glutation ridotto deriva dall'aminoacido glicina, glutammato e cisteina, come già accennato, e la sua sintesi inizia con l'attivazione (usando ATP) del gruppo γ-carbossil di glutammato (del gruppo R) per formare un intermediario fosfato acil che viene attaccato dal gruppo α-amino della cisteina.
Questa prima reazione di condensazione di due aminoacidi è catalizzata dalla γ-glutamilcistein sintetasi ed è generalmente influenzata dalla disponibilità intracellulare degli aminoacidi glutammato e cisteina.
Il dipéptide così formato viene successivamente condensato da una molecola di glicina grazie all'azione della sintetasi GSH. Durante questa reazione, si verifica anche un'attivazione ATP del gruppo α-carbossilico della cisteina per formare un acile fosfato e quindi favorire la reazione con il residuo di glicina.
Glutatione ossidato (GSSG)
Quando il glutatione ridotto partecipa alle reazioni di riduzione dell'ossido, la forma ossidata è in realtà costituita da due molecole di glutatione attaccate tra loro attraverso ponti disulfur; È per questo motivo che la forma arrugginita è abbreviata con l'acronimo "GSSG".
La formazione delle specie ossidate di glutatione dipende da un enzima noto come ma perossidasi o perossidasi GSH, che è una perossidasi che contiene una selenocisteina (un residuo di cisteina che invece di avere un atomo di zolfo ha uno di selenio) Posizionare una risorsa.
L'interconversione tra forme ossidate e ridotte viene data grazie alla partecipazione di una glutation reduttasi o reduttasi GSSG.
Vantaggi della tua assunzione
Il glutation può essere somministrato orale, topico, endovenoso, intranasale o nebulizzato, al fine di aumentare la loro concentrazione sistemica nei pazienti che soffrono di stress ossidativo, ad esempio.
Cancro
Le indagini condotte per quanto.
HIV
Generalmente, i pazienti infettati dal virus dell'immunodeficienza acquisita (HIV) hanno carenze intracellulari di glutatione sia nei globuli rossi che nelle cellule T e nei monociti, che condiziona il loro corretto funzionamento.
In uno studio condotto da Morris e collaboratori, è stato dimostrato che la fornitura di glutatione ai macrofagi di pazienti sieropositivi ha notevolmente migliorato la funzione di queste cellule, specialmente di fronte alle infezioni con agenti patogeni opportunistici come M. tubercolosi.
Attività muscolare
Altri studi hanno a che fare con il miglioramento dell'attività contrattile dei muscoli, della difesa antiossidativa e del danno ossidativo causato in risposta alle lesioni dell'ischemia/riperfusione dopo la somministrazione orale di GSH durante l'allenamento della resistenza fisica.
Patologie epatiche
È stato considerato, a sua volta, che la sua assunzione o somministrazione per via endovenosa abbia funzioni nella prevenzione del progresso di alcuni tipi di cancro e nella riduzione del danno cellulare che si verificano a seguito di alcune patologie epatiche.
Può servirti: acidi grassi essenziali: funzioni, importanza, nomenclatura, esempiAntiossidante
Sebbene non tutti gli studi riportati siano stati condotti in pazienti umani, ma di solito si tratta di test in modelli animali (generalmente murini), i risultati ottenuti in alcuni studi clinici affermano l'efficacia del glutatione esogeno come antiossidante.
Per questo motivo, viene utilizzato per il trattamento della cataratta e del glaucoma, come prodotto "anti-invecchiamento", per il trattamento dell'epatite, numerose malattie cardiache, perdita di memoria e per il rafforzamento del sistema immunitario e per la purificazione dopo avvelenamento con metalli pesanti e droghe.
"Assorbimento"
Il glutathión somministrato esogeno non può entrare nelle cellule a meno che non venga idrolizzato ai loro aminoacidi costituenti. Pertanto, l'effetto diretto della somministrazione (orale o endovenoso) di questo composto è l'aumento della concentrazione intracellulare di GSH grazie al contributo degli aminoacidi necessari per la loro sintesi, che può essere effettivamente trasportato nel citosol.
Effetti collaterali
Sebbene si ritiene che l'assunzione di glutatione sia "sicura" o innocua, non sono stati condotti studi sufficienti sui loro effetti collaterali.
Tuttavia, dei pochi studi riportati è noto che può avere effetti negativi che derivano dall'interazione con altri farmaci e che possono essere dannosi per la salute in vari contesti fisiologici.
Se viene preso a lungo termine, sembra che i livelli di zinco agiscano in una diminuzione eccessiva.
Riferimenti
- Allen, j., & Bradley, R. (2011). Effetti del glutation orale. Il diario di medicina alternativa e complementare, 17(9), 827-833.
- Conklin, k. A. (2009). Antiossidanti dietetici durante la chemioterapia del cancro: impatto sull'efficacia chemioterapica e sviluppo degli effetti collaterali. Nutrizione e cancro, 37(1), 1-18.
- Meister, a. (1988). Metabolismo del glutatione e la sua modifica selettiva. Il Journal of Biological Chemistry, 263(33), 17205-17208.
- Meister, a., & Anderson, M. E. (1983). Glutatione. Ann. Rev Biochem., 52, 711-760.
- Morris, d., Guerra, c., Khurasany, m., Guilford, f., & Savola, B. (2013). Glutationa Supplementation Improvement Macrofage Funzioni nell'HIV. Journal of Interferon & Cytokine Research, undici.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, p. (2009). Biochimica illustrata di Harper (28 ° ed.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Principi di biochimica Lechinger. Omega Editions (5 ° ed.). https: // doi.org/10.1007/S13398-014-0173-7.2
- Noctor, g., Mhamdi, a., Chaouch, s., Han, e. Yo., Neukermans, j., Marquez-Garcia, b.,... Foyer, C. H. (2012). Glutatione nelle piante: una panoramica integrata. Pianta, cell e ambiente, 35, 454-484.
- Pizzorno, J. (2014). Glutatione! Medicina investigativa, 13(1), 8-12.
- Qanungo, s., Starke, d. W., Pai, h. V, Myyal, J. J., & Nieminen, a. (2007). Glutation. Il Journal of Biological Chemistry, 282(25), 18427-18436.
- Ramires, p. R., & Ji, l. L. (2001). La supplementazione e l'allenamento del glutationa aumentano la resistenza del miocardio a ischemia-reperfusione in vivo. Ann. J. Fisiolo. Cuore Circ. Fisiolo., 281, 679-688.
- Sies, h. (2000). Glutatione e suo ruolo nelle funzioni cellulari. Biologia e medicina radicali liberi r, 27(99), 916-921.
- Wu, g., Fang, e., Yang, s., Lupton, j. R., & Turner, N. D. (2004). Metabolismo del glutatione e le sue implicazioni per la salute. American Society for Nutritional Sciences, 489-492.

