Modello di gas ideale, comportamento, esempi
- 4926
- 149
- Ruth Cattaneo
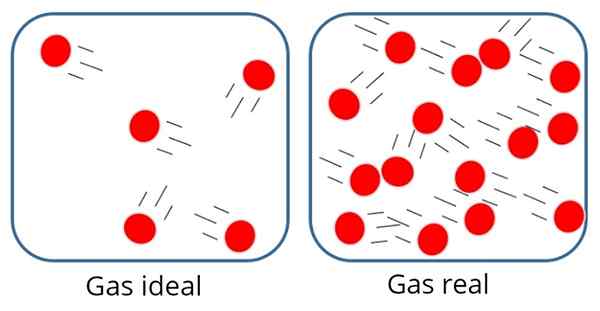
UN Gas ideale O Gas perfetto È quello in cui la forza di attrazione o repulsione molecolare è considerata insignificante tra le particelle che la compongono, quindi tutta la sua energia interna è cinetica, cioè energia associata al movimento.
In tale gas, le particelle sono generalmente abbastanza lontane l'una dall'altra, sebbene occasionalmente si scontrano tra loro e con le pareti del contenitore.
 Nel gas ideale le particelle sono lontane l'una dall'altra
Nel gas ideale le particelle sono lontane l'una dall'altra D'altra parte, nel gas ideale le dimensioni o la massa delle particelle non importano, poiché il volume da esse occupato dovrebbe essere molto piccolo rispetto al volume del gas stesso.
Questo, ovviamente, è solo un approccio, perché in realtà c'è sempre un certo grado di interazione tra atomi e molecole. Sappiamo anche che le particelle occupano spazio e hanno massa.
Tuttavia, queste ipotesi funzionano abbastanza bene in molti casi, come i gas a basso peso molecolare, in una buona gamma di pressioni e temperature.
Tuttavia, i gas di alto peso molecolare, specialmente ad alte pressioni o basse temperature, non si comportano affatto come gas ideali e hanno bisogno di altri modelli creati con lo scopo di descriverli con maggiore precisione.
[TOC]
Primi esperimenti
Le leggi che governano i gas sono empiriche, cioè sono nate dalla sperimentazione. Gli esperimenti più notevoli furono condotti nel diciassettesimo, diciottesimo e all'inizio del diciannovesimo secolo.
I primi sono quelli di Robert Boyle (1627-1691) e Edme Mariotte (1620-1684), che hanno modificato indipendentemente il pressione in un gas e ha registrato il loro cambio di volume, scoprire che erano inversamente proporzionali: a maggiore pressione, meno volume.
 Robert Boyle
Robert Boyle Da parte sua, Jacques Charles (1746-1823) stabilì quel volume e temperatura L'assoluto erano direttamente proporzionali, purché la pressione rimanesse costante.
Può servirti: onde stazionarie: formule, caratteristiche, tipi, esempiAmadeo Avogadro (1776-1856) scoprì che due volumi identici di gas diversi contenevano la stessa quantità di particelle, purché la pressione e la temperatura fossero le stesse. E infine Joseph de Gay Lussac (1778-1850), ha affermato che mantenendo il volume fisso, la pressione in un gas è direttamente proporzionale alla temperatura.
Le leggi dei gas ideali
Queste scoperte sono espresse attraverso semplici formule, chiamando P alla pressione, V al volume, N al numero di particelle e T La temperatura del gas ideale:
Legge di Boyle-Maleotte
A condizione che la temperatura sia fissa, si verifichi quanto segue:
P⋅v = costante
Charles Law
Quando il gas è sotto costante pressione:
V / t = costante
Legge gay di Lussac
Mantenere il gas a un volume fisso è vero che:
p / t = costante
Legge Avogadro
Volumi di gas identici, nelle stesse condizioni di pressione e temperatura hanno lo stesso numero di particelle. Quindi possiamo scrivere:
V ∝ n
Dove n è il numero di particelle e ∝ è il simbolo della proporzionalità.
Modello di gas ideale
Il modello di gas ideale descrive un gas tale che:
-Quando le particelle interagiscono lo fanno per un tempo molto breve, attraverso scontri elastici, in cui vengono conservati l'impeto e l'energia cinetica.
-Le sue particelle costituenti sono puntuali, in altre parole, il suo diametro è molto inferiore alla distanza media che viaggiano tra l'una e l'altra collisione.
-Le forze intermolecolari non sono esistenti.
-L'energia cinetica è proporzionale alla temperatura.
Gas monoatomici - i cui atomi non sono collegati tra loro - e basso peso molecolare, in condizioni standard di pressione e temperatura (pressione atmosferica e temperatura 0 º C), hanno un comportamento tale per cui il modello di gas ideale è una descrizione molto buona loro.
Può servirti: Vy Canis Majoris: Discovery, Caratteristiche, Struttura, Formazione ed EvoluzioneEquazione dello stato del gas ideale
Le leggi dei gas di cui sopra sono combinate per formare l'equazione generale che governa il comportamento del gas ideale:
V ∝ n
V ∝ t
Perciò:
V ∝ n⋅t
Inoltre, della legge di Boyle:
V = costante / p
Allora possiamo affermare che:
V = (costante x n⋅t) / p
La costante è chiamata costante di gas Ed è indicato dalla lettera r. Con questa scelta, l'equazione del gas ideale mette in relazione quattro variabili che descrivono lo stato del gas, vale a dire N, R, P e T, lasciando:
P⋅v = n⋅R⋅t
Questa equazione relativamente semplice è coerente con le leggi dei gas ideali. Ad esempio, se la temperatura è costante, l'equazione è ridotta alla legge Boyle-Maleotte.
La costante del gas
Come abbiamo detto prima, in condizioni di temperatura e pressione standard, cioè a 0 ° C (273.15 k) e 1 atmosfera di pressione, il comportamento di molti gas è vicino al gas ideale. In queste condizioni, il volume di 1 moli di gas è 22.414 l.
In quel caso:
R = (p⋅v) / (n⋅t) = (1 atm x 22.414 L) / (1 mol x 273.15 k) = 0.0821 atm ⋅ l /mol ⋅ K
La costante di gas può anche essere espressa in altre unità, ad esempio nel sistema internazionale se vale:
R = 8.314 J⋅ mol-1⋅ k-1
Quando un problema viene risolto attraverso la legge sui gas ideali, è conveniente prestare attenzione alle unità in cui la costante è espressa, poiché come possiamo vedere, ci sono molte possibilità.
Comportamento di un gas ideale
Come abbiamo detto, qualsiasi gas in condizioni standard di pressione e temperatura che è a basso peso molecolare, si comporta molto vicino al gas ideale. Pertanto, l'equazione p⋅v = n⋅R⋅t è applicabile per trovare la relazione tra le quattro variabili che la descrivono: n, p, v e t.
Può servirti: modello atomico HeisenbergIn questo modo possiamo immaginare una porzione di gas ideale bloccata in un contenitore e formata da minuscole particelle, che occasionalmente si scontrano tra loro e con le pareti del contenitore, sempre elasticamente.
Questo è ciò che vediamo nella seguente animazione di una porzione di elio, un gas nobile e monoatomico:
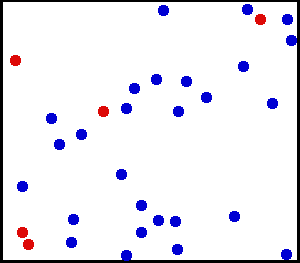 L'elio è un gas nobile, nell'animazione Una porzione di atomi di elio è mostrata in un contenitore. Quelli rossi servono a distinguere meglio il movimento. Fonte: Wikimedia Commons.
L'elio è un gas nobile, nell'animazione Una porzione di atomi di elio è mostrata in un contenitore. Quelli rossi servono a distinguere meglio il movimento. Fonte: Wikimedia Commons. Esempi di gas ideali
Un gas ideale è un gas ipotetico, cioè è un'idealizzazione, tuttavia, in pratica molti gas si comportano in modo molto ravvicinato, rendendo possibile per il modello P⋅v = n⋅R⋅t preciso.
gas nobili
Esempio di gas che si comportano come ideali in condizioni standard sono gas nobili, nonché gas chiaro: idrogeno, ossigeno e azoto.
Il palloncino aerostatico
 Il modello di gas ideale spiega come la mongolfiera. Fonte: Wikimedia Commons.
Il modello di gas ideale spiega come la mongolfiera. Fonte: Wikimedia Commons. Al palloncino aerostatico della Figura 1 può essere applicato dalla legge di Charles: il gas viene riscaldato, quindi l'aria che riempie il globo si espande e di conseguenza aumenta.
Palloncini di elio
L'elio è, insieme all'idrogeno, l'elemento più comune nell'universo, eppure è scarso sulla terra. Poiché un gas nobile è inerte, a differenza dell'idrogeno, quindi i palloncini pieni di elio sono ampiamente usati come elementi decorativi.
Riferimenti
- Atkins, p. 1999. Chimica fisica. Omega Editions.
- Chang, R. 2013. Chimica. 11va. Edizione. Mc Graw Hill Education.
- Cengel, e. 2012. Termodinamica. 7a edizione. McGraw Hill.
- Cimbala, c. 2006. Meccanica di fluidi, fondamenti e applicazioni. MC. Graw Hill.
- Giambattista, a. 2010. Fisica. 2 °. Ed. McGraw Hill.
- « Caratteristiche dell'ambiente naturale, elementi, importanza, esempi
- Esempi e caratteristiche di funzioni appellative »

