Galvanoplastica

- 654
- 62
- Lino Lombardi
Spieghiamo cosa consiste la galvanoplastica, chiamata anche elettrodeposizione, come è il suo processo, esempi pratici e le sue applicazioni.
 Galvanoplastica di un cucchiaio
Galvanoplastica di un cucchiaio Cos'è la galvanoplastica?
La galvanoplastica o l'elettrodeposizione è una tecnica elettrochimica che consiste, come suggerisce il nome, nel depositare strati di metalli sulla ricezione di oggetti; Cioè, coprendoli da una copertura metallica, il cui spessore varia tra 5-20 μm.
Questa tecnica è anche conosciuta come elettrochapado o elettrolitica, come un mezzo elettrolitico composto da ioni metallici del metallo che si desidera depositare è indispensabile per la sua implementazione. Pertanto, se desideriamo un rame placcato (rame), avremo bisogno di sali solubili in rame, come il solfato di rame, sciolti in acqua.
Il ragionamento precedente si applica a qualsiasi altro metallo: un placcato elettrolitico d'oro richiederà sali d'oro, generalmente cianuri d'oro, che possono diventare molto tossici. Pertanto, alcuni oggetti, come gli utensili alimentari, possono essere ricoperti di oro per assegnare un valore e una nobiltà maggiore.
Ma la galvanoplastica va oltre l'estetica: sono conferiti. Consente inoltre di salvare le risorse naturali, poiché non è necessario spendere grandi quantità di metallo per i rivestimenti.
Processo di galvanoplastica
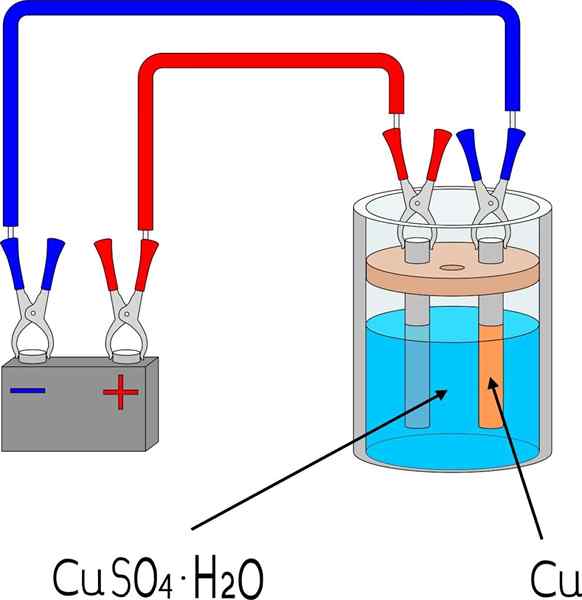 Elettrodeposizione di rame in un bagno di solfato di rame
Elettrodeposizione di rame in un bagno di solfato di rame Elementi
Per elettrodeposo un metallo su una superficie, sono necessari alcuni elementi di base, le cui dimensioni e modalità varieranno a seconda del lotto di oggetti da coprire.
Nell'immagine superiore, ad esempio, viene mostrato l'elettrodo di rame su piccola scala, riproducibile in qualsiasi laboratorio o spazio.
Mezzo elettrolitico
Innanzitutto, è necessario un mezzo elettrolitico del metallo in elettrodepositi. Sale di solfato di rame, CUO4, È molto solubile in acqua, quindi porta ioni Cu2+ che verrà quindi ridotto agli atomi Cu0. Questi atomi sono quelli che saranno assemblati sulla superficie ricevente per dare origine a cristalli di metallo.
Il mezzo elettrolitico è indispensabile per il funzionamento del circuito e i carichi ionici possono muoversi o mobilitarsi verso la regione in cui si verifica l'elettrodeposizione.
Elettrodi
Gli elettrodi sono le superfici su cui si verifica l'elettrodeposizione dalla sua base chimica. In termini semplici ci sono due elettrodi: il catodo, che è dove il metallo è elettrodepos; E l'anodo, che è dove avviene una reazione chimica che dona elettroni agli ioni metallici che copriranno il catodo.
Può servirti: uretano: struttura, proprietà, ottenimento, usiCioè, il catodo diventa il pezzo che si desidera. Nel frattempo, l'anodo è qualsiasi superficie su cui una specie si ossida e dona i suoi elettroni al catodo. Molte volte l'anodo è realizzato con lo stesso metallo che viene sciolto nell'ambiente elettrolitico. Se c'è il rame ionico nel mezzo, in questo caso l'anodo sarà rame metallico.
Circuito esterno
Il circuito esterno è una batteria che fornisce gli elettroni iniziali che promuovono l'elettrodeposizione. La sua presenza significa che la reazione non è spontanea: è necessaria l'elettricità per generare un cambiamento chimico, che è la riduzione degli ioni metallici disciolti.
Pulizia dell'elettrodo
Il pezzo da coprire deve essere completamente pulito. Altrimenti, il rivestimento placcato o il rivestimento sarà difettoso.
Per fare ciò, devi assicurarti che la sua superficie sia interamente idrofila, cioè non ha grasso o sporco. Un modo per garantire questo, dopo il lavaggio chimico, è bagnare il pezzo con acqua e se si osserva la formazione di cadute d'acqua o una goccia liquida non uniforme, significa che l'elettrodo non è ancora pulito.
Reazioni e significato degli elettroni
La galvanoplastica è una reazione redox. Pertanto: una specie deve essere ridotta, mentre l'altra ossidazione o viceversa. Nel rame, abbiamo un anodo fatto di rame e un catodo fatto di me in metallo (ferro, zinco, stagno, ecc.).
Quando accendiamo la batteria, scorreranno gli elettroni sul catodo, che inizia a caricare negativamente.
Il carico negativo del catodo attira i cationi Cu2+ dell'ambiente elettrolitico, che si svolge la riduzione:
Cu2+(AC) +2E- → Cu (s)
Può servirti: reazione di MaillardLa batteria deve recuperare gli elettroni donati e anche gli ioni Cu devono essere recuperati2+ ridotto per mantenere la neutralità dell'ambiente elettrolitico. Questo è quando l'anodo è disponibile in funzione: gli atomi di rame si ossida:
Cu (s) → Cu2+(AC) +2E-
E gli elettroni rilasciati sono riportati alla batteria, che a sua volta li mobilita verso il catodo per continuare l'elettrodeposizione.
L'anodo sta guadagnando carico positivo, che attira gli ioni così42- del mezzo elettrolitico (vedi di nuovo l'immagine).
Cioè, le reazioni che si verificano è la riduzione e l'ossidazione del rame, il metallo che è Electrodepos:
Cu2+(AC) +2E- → Cu (s)
Cu (s) → Cu2+(AC) +2E-
L'anodo, di rame, sta perdendo l'impasto mentre il catodo, di un altro metallo, è coperto da uno strato di rame fine.
Esempi di galvanoplastica
Argento
I metalli possono essere "elettroplate", che li copre elettroliticamente da uno strato d'argento. Ciò è particolarmente vantaggioso nei componenti elettronici che devono condurre elettricità. L'argento può essere elettrodeposita su acciaio, rame, nichel e altri metalli.
In scatola
Il tinner è l'elettrodeposizione di stagno. È molto utile nella produzione di lattine di ferro, che sono coperte di stagno per renderle resistenti alla corrosione, e quindi non danneggiare gli alimenti o i prodotti che immagazzinano.
Latino o marrone chiaro
Sebbene un po 'più elaborato, l'ottone e il bronzo possono anche essere elettrodepos su alcuni metalli per migliorare il loro aspetto.
Zincado
La galvanoplastica di zinco o zinco (non confusa con zincatura termica) è utilizzata principalmente per concedere la resistenza al ferro alla corrosione e superfici più luminose e più attraenti. Pertanto, la sua funzione è estetica e allo stesso tempo funzionale e si trova in parti del corpo come le ruote.
Plastica metallica
Le plastiche, precedentemente trattate per avere una superficie conduttiva, possono anche essere coperte di metallo, che è come se fossero aderiti a un foglio di foglio di alluminio.
Può servirti: matraccio kitasatoApplicazioni di galvanoplastica
Le applicazioni di galvanoplastica o elettrodeposizione possono essere divise in funzionale o estetica.
Funzionale
 Un sottile elettrodepo d'oro negli spettatori dei casi di astronauti consente loro di proteggere i loro occhi dalla luce solare
Un sottile elettrodepo d'oro negli spettatori dei casi di astronauti consente loro di proteggere i loro occhi dalla luce solare Il rivestimento di un pezzo o un oggetto è fornire alla sua superficie proprietà che da sole. Ad esempio, l'elettrodoposizione di rame o oro realizza i pezzi che hanno, quindi è l'ideale nei circuiti elettronici per sfruttare le proprietà di questi metalli, senza la necessità di spendere tonnellate d'oro per la produzione di pezzi interi e solidi.
L'oro, d'altra parte, protegge le superfici di calore e radiazioni. È per questo motivo che è ampiamente usato nei satelliti e nei caschi degli astronauti, poiché riflette la luce del sole, quindi la prevale i loro occhi, o rapidamente calda.
Gli acciai cromati o nickicati sono molto resistenti alla corrosione grazie proprio a questi strati di metallo. Ecco perché la galvanoplastica viene utilizzata nel settore per proteggere i metalli sensibili a corrode.
Estetica
Le faccette metalliche brillano. Zinco, nichel e cromo sono molto usati per questo scopo. Inoltre, l'oro e l'argento sono elettrodepos in anelli, catene, bracciali, choker, pendii, ecc., E quindi la sua galvanoplastica trova molte applicazioni nei negozi di gioielli e nelle ornamenti, per migliorare l'immagine e il prestigio di questi indumenti.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2021). Elettroplazione. Recuperato da: in.Wikipedia.org
- Chris Woodford. (28 luglio 2020). Come funziona l'elettroplaggio. Estratto da: ExplInThatStuff.com
- Rob Snyder. (S.F.). Elettrodeposizione di nanoscala. STEM Education Institute. [PDF]. Recuperato da: nanosci.Unc.Edu
- Elsevier b.V. (2021). Elettrodeposizione. Scienceirect. Estratto da: ScienceDirect.com
- Vaishali Mittal. (10 dicembre 2020). Elettroplazione. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Singh Davneet. (9 giugno 2020). Diversi tipi di elettropli. Recuperato da: insegnareo.com
- Helmestine, Anne Marie, PH.D. (26 agosto 2020). Cosa è elettroplato e come funziona? Recuperato da: Thoughtco.com

