Van der Waals forze
- 3424
- 204
- Kayla Serr
Spieghiamo quali van der Waals sono le forze, le loro caratteristiche, tipi e diamo esempi in ciascuno
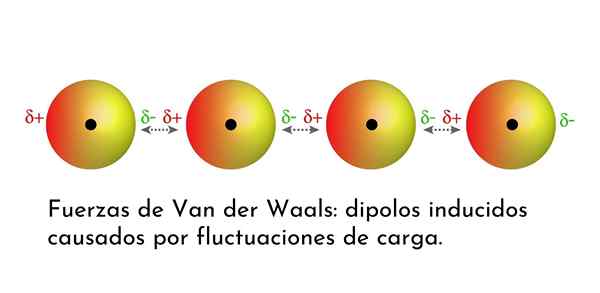
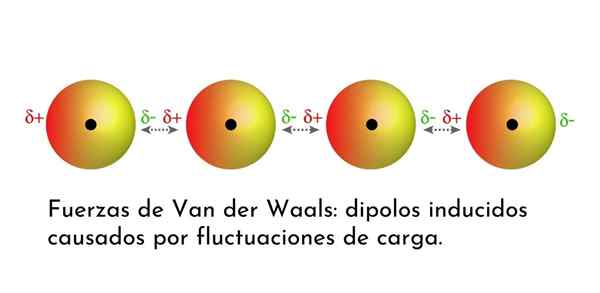 Illustrazione che mostra uno dei tipi di forze di Van der Waals, le forze di dispersione di Londra, tra diversi atomi con dipolo istantaneo
Illustrazione che mostra uno dei tipi di forze di Van der Waals, le forze di dispersione di Londra, tra diversi atomi con dipolo istantaneo Quali sono le forze di Van der Waals?
IL Van der Waals forze Sono un insieme di forze di attrazione a corto raggio tra tutti gli atomi e le molecole. Ricevono il loro nome in onore dello scienziato olandese Johannes Diderik van der Waals.
Queste forze sono relativamente deboli, ma compaiono sull'intera superficie di contatto tra due atomi, tra due molecole o tra due superfici, quindi se detto superficie di contatto è grande, le forze di van der Waals possono diventare considerevoli.
La comprensione delle forze di van der Waals consente di prevedere qualitativamente molte proprietà fisiche delle sostanze chimiche, come i loro punti di fusione e ebollizione e solubilità in diversi tipi di solventi. Queste sono le forze che consentono di spiegare come è possibile che un gas monoatomico come l'elio, che non forma alcun tipo di legame chimico, possa condensare e spostarsi allo stato liquido.
Queste forze spiegano anche perché una sostanza come l'acqua, che è formata da molecole la cui massa molare è solo 18 g/mol, è liquido, mentre il cloro, che pesa quasi 4 volte di più, è un gas a temperatura ambiente.
Caratteristiche delle forze di van der Waals
Oltre a rappresentare un tipo di forza di attrazione tra atomi e molecole, le forze di Van der Waals non condividono molte caratteristiche con legami chimici. Successivamente, vengono presentate le caratteristiche più eccezionali di questo tipo di forze:
- Sono forze dipendenti dalla distanza. Nel caso più semplice, diminuiscono con il quadrato della distanza. Inoltre, dipendono fortemente dalla geometria molecolare.
- Rispetto alle forze di attrazione che si verificano in collegamenti ionici, covalenti e metallici, le forze di van der Waals sono relativamente deboli.
- Con l'eccezione delle interazioni dipolo-dipolo, sono interazioni di temperatura indipendenti.
- Sono forze a corto -raggio, il che significa che diminuiscono rapidamente mentre gli atomi e le molecole si allontanano.
- Sono forze generali che si verificano tra qualsiasi atomo e qualsiasi molecola.
- A differenza dei legami covalenti, non hanno direzionalità. Ciò significa che, indipendentemente dall'orientamento con cui si avvicinano due molecole, se si avvicinano abbastanza, le forze di Van der Waals appariranno sempre.
- Quando due molecole o atomi si avvicinano troppo, la forza diventa ripugnante, il che impedisce alle molecole di collassare l'un l'altro.
- Sono additivi, il che significa che, nonostante siano considerevolmente deboli, l'esistenza di molte interazioni simultanee può far sì che la forza di attrazione totale sia considerevole.
Tipi di forze di van der Waals
Oltre alla componente repulsiva che garantisce che atomi e molecole non collassino, ci sono tre tipi di forze di van der Waals, che possono o non possono agire allo stesso tempo tra due molecole o atomi. Questi sono presentati di seguito:
1. Interazioni dipolo-dipolo o forze di keesom
La forza di Keesom è uno dei contribuenti alla forza di Van der Waals. Queste sono le forze di interazione elettrostatica che compaiono tra i dipoli permanenti delle molecole polari come l'acqua, l'acetone e altri.
Le forze di Keesom sono simili alle forze elettrostatiche tra gli ioni, ma differiscono da queste in quanto sono molto più deboli e decadiscono con la sesta potenza di distanza (cioè con R6). Il motivo per cui sono più deboli è che l'attrazione si verifica tra i carichi parziali di un dipolo, anziché le cariche elettriche intere come nel caso degli ioni.
Queste interazioni sono fornite solo tra molecole e non tra atomi, poiché gli atomi non hanno momenti di dipolo permanente. Inoltre, la forza di Keesom è inversamente proporzionale alla temperatura, il che significa che, quando aumenta, la forza di Keesom diminuisce.
Esempi di molecole che hanno interazioni dipolo-dipolo
Tutte le molecole polari hanno interazioni dipolo-dipolo tra loro. Per esempio:
- Due molecole di acetone.
- Due molecole di cloroformio.
- Una molecola cicloesanone con una molecola di acetone.
2. Interazioni dipolo-dipolo indotte o forze di debye
Quando una molecola polare si avvicina a un atomo o una molecola apolare, il dipolo della prima attira o ripete elettroni sulla superficie del secondo. Questo induce un dipolo nella molecola apolare, che si chiama dipolo indotto. Il nuovo dipolo si è formato, quindi interagisce con il dipolo originale che crea una piccola forza di attrazione.
Può servirti: calore a combustioneQueste interazioni tra un dipolo permanente e indotto sono generalmente conosciute come forze di debye e dipendono non solo dalla distanza tra le due molecole o tra la molecola polare e un atomo individuale, ma dipendono anche dalla polarizzabilità della molecola apolare e della grandezza del momento dipolo della molecola polare.
Esempi di molecole che hanno indotto interazioni dipolo-dipolo
Questo tipo di interazioni è dato solo tra molecole diverse, poiché uno è necessario per essere polari e che l'altro no. Alcuni esempi sono:
- Un atomo di un gas nobile come l'argon e un composto polare come l'idrogeno cloruro. In questo caso, il carico parziale positivo nell'idrogeno HCl attira gli elettroni di Valencia dell'argon, generando un piccolo dipolo indotto in quest'ultimo. Se un argon si avvicina all'atomo di cloro, il carico parziale negativo respingerà gli elettroni di valenza e si forma anche un dipolo indotto.
- Il brominato molecolare (BR2) È considerevolmente solubile in acqua, nonostante sia un composto apolare e l'acqua di un solvente fortemente polare. La spiegazione è dovuta, in parte, all'elevata polarizzazione del bromo che consente di formare interazioni considerevolmente forti.
3. Interazioni indotte da dipolo indotte o forze di dispersione di Londra
Di tutte le forze di Van der Waals, le più deboli sono le forze di dispersione di Londra. Queste interazioni sono fornite tra tutti gli atomi e le molecole a causa della comparsa di dipoli istantanei in qualsiasi parte della loro struttura.
Un dipolo istantaneo è un piccolo dipolo che è formato da una distribuzione asimmetrica di elettroni di valenza in un determinato momento.
Può servirti: idrocarburi insaturiCome vengono generati i dipoli istantanei?
Poiché gli elettroni ruotano attorno al nucleo, può accadere che un tempo ci siano più elettroni su un lato che dall'altro, il che dà origine a un dipolo. Questo piccolo dipolo scompare rapidamente mentre gli elettroni continuano a muoversi attorno al nucleo, ed è per questo che sono chiamati istantanee.
I dipoli istantanei possono sorgere ovunque nella struttura di una molecola e in qualsiasi momento potrebbero essercene molti. Le forze di dispersione di Londra consistono nell'interazione tra questi tempi istantanei in una molecola e quelle di un'altra.
Esempi di composti che hanno forze di dispersione di Londra
Come accennato, questi tipi di interazioni si verificano tra tutti gli atomi e le molecole. Tuttavia, è nelle grandi molecole apolari in cui il suo effetto può essere meglio osservato, poiché in questi casi è l'unico tipo di interazione intermolecolare che si verifica.
Un esempio tipico in cui queste forze sono molto intense è nel caso di idrocarburi alifatici a catena lunga, specialmente in polimeri come il polietilene.

