Struttura del fluoro di magnesio, proprietà, sintesi, usi
- 3744
- 254
- Enzo De Angelis
Lui Fluoruro di magnesio È un sale inorganico incolore la cui formula chimica è MGF₂. Si trova in natura come il minerale di Sealíta. Ha un punto di fusione molto alto ed è molto poco solubile in acqua. È relativamente inerte, perché, ad esempio, la sua reazione all'acido solforico è lenta e incompleta e resiste all'idrolisi con acido fluorico (HF) a 750 ° C.
È un composto poco affetto da radiazioni ad alta energia. Inoltre, ha un indice di rifrazione basso, un'alta resistenza alla corrosione, una buona stabilità termica, una durezza significativa e un'eccellente proprietà di trasmissione della luce visibile, UV (ultravioletta) e IR (infrarosso).

Queste proprietà hanno prestazioni eccellenti nel campo ottico e, inoltre, lo rendono un materiale utile come supporto catalizzatore, elemento di rivestimento, obiettivi antiflex e finestre per trasmissione a infrarossi, tra le altre applicazioni.
[TOC]
Struttura
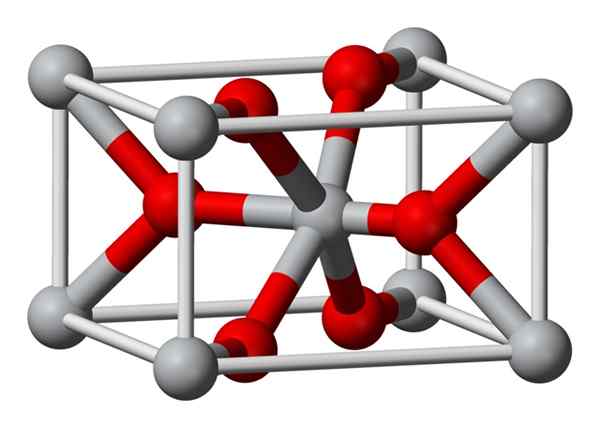
La struttura cristallina del fluoruro di magnesio preparato chimicamente è lo stesso tipo di quello del minerale naturale Sellaíta. Cristallizza nella classe dipiramidale del sistema tetragonale.
Gli ioni di magnesio (Mg2+) si trovano in uno spazio centrato sul tetragonal, mentre gli ioni fluoruro (f-) si trovano nello stesso piano dei loro vicini MG2+ e associati a questi, raggruppati in coppia con ciascuno. La distanza tra gli ioni Mg2+ e gli F-F è 2,07 Å (Angstroms) (2,07 × 10-10 m).
La sua coordinazione cristallina è 6: 3. Ciò significa che ogni ione mg2+ è circondato da 6 ioni f- e ogni ione f-, a sua volta, è circondato da 3 mg2+ 5 ioni.
La struttura è molto simile a quella del minerale di Rutilo, che è la forma naturale di biossido di titanio (TiO2), con cui ha diverse proprietà cristalliche in comune.
Durante l'ottenimento, il fluoruro di magnesio non precipita sotto forma di solido amorfo, poiché Mg2+ e F-ioni non tendono a formare complessi polimerici in soluzione.
Proprietà
È interessante sottolineare che il fluoruro di magnesio è un materiale birrefringente. Questa è una proprietà ottica che ti consente di aprire un raggio di luce incidente in due raggi separati che si diffondono a diverse onde e lunghezze d'onda.
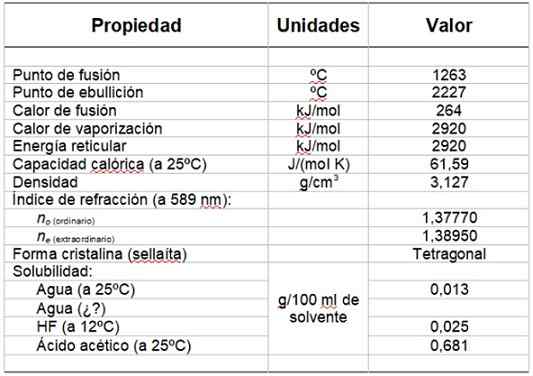
Può servirti: gruppo idrossilicoLa tabella 1 mostra alcune delle sue proprietà.
Tabella 1. Proprietà fisiche e chimiche del fluoruro di magnesio.
Sintesi e preparazione
Può essere preparato in diversi modi, tra cui i seguenti possono essere menzionati:
1 perché la reazione tra ossido di magnesio (MgO) o carbonato di magnesio (MGCO3) con acido fluoruro (HF) 2:
MgO + 2 HF MGF2 + H2O
MgCo3 + 2 HF MGF2 + CO2 + H2O
Reazione 2-per tra carbonato di magnesio e ammonio bifluoro (NH4HF2), sia in stato solido, a una temperatura tra 150 e 400ºC2:
150-400ºC
MgCo3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-Calento Una soluzione acquosa di carbonato di magnesio e fluoruro di ammonio (NH4F) in presenza di idrossido di ammonio (NH4OH) a 60 ° C 2:
60ºC, NH4OH
MgCo3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Il precipitato di fluoruro di ammonio e magnesio (NH4MGF3) viene quindi riscaldato a 620 ° C per 4 ore per ottenere fluoro di magnesio:
620ºC
NH4MGF3 MGF2 + NH3 + HF
4-come sottoprodotto dell'ottenimento di berillio (BE) e uranio (U). Il fluoruro dell'elemento desiderato con magnesio metallico viene riscaldato in un melting pot coperto di MGF2:
Bef2 + mg be + mgf2
Cloruro di magnesio react a 5-battito (MGCL2) con fluoruro di ammonio (NH4F) in soluzione acquosa a temperatura ambiente 3:
25 ° C, H2O
MGCL2 + 2 NH4F MGF2 + 2NH4Cl
Poiché i metodi di preparazione di MGF2 sono costosi, ci sono tentativi di ottenerlo in modo più economico, tra cui il metodo di produrre dall'acqua di mare.
Può servirti: idruro di calcio (CAH2): proprietà, reattività e usiQuesto è caratterizzato dall'aggiunta di abbastanza ioni fluoruro (F-) all'acqua di mare, che ha una concentrazione abbondante di ioni di magnesio (MG2+), favorendo così la precipitazione di MGF2.
I cristalli di fluoruro di magnesio ottico sono ottenuti mediante pressione calda da MGF2 di alta qualità, ad esempio, con il metodo NH4HF2.
Esistono molte tecniche per preparare materiali a fluoro di magnesio, come crescita del vetro singolo, sinterizzazione (compattazione a muffa o forma) senza pressione, calda e sinterizzazione premuti con forno a microonde.
Applicazioni
Ottica
I cristalli MGF2 sono adatti per applicazioni ottiche perché sono trasparenti dalla regione UV alla media IR 2,10.
Poiché un film inerte viene utilizzato per alterare le proprietà di trasmissione della luce dei materiali ottici ed elettronici. Una delle applicazioni principali è nell'ottica VUV per la tecnologia di esplorazione dello spazio.
A causa della sua proprietà Birrefringency, questo materiale è utile nell'ottica di polarizzazione, nelle finestre e prismi laser Ecimer (tipo laser ultravioletto utilizzato nella chirurgia oculare).
Va notato che il fluoruro di magnesio utilizzato nella produzione di materiali ottici di film sottile deve essere privo di impurità o composti che sono fonti di ossido, come acqua (H2O), ioni idrossido (OH-), ioni carbonati (CO3 = ), Ioni solfato (SO4 =) e simili 12.
Catalisi o accelerazione delle reazioni
L'MGF2 è stato utilizzato con successo come supporto catalizzatore per la reazione dell'eliminazione del cloro e l'aggiunta di idrogeno nello strato di ozono dell'ozono di clorofluorocarburi), e responsabili del danno.
I composti risultanti, HFC (idrofluorocarberi) e HCFC (idroclorofluorocarberi), non presentano questo effetto dannoso sull'atmosfera 5.
È stato anche utile come supporto per i catalizzatori per l'idrodesulfrazione (eliminazione dello zolfo) dei composti organici.
Può servirti: equilibrio chimico: spiegazione, fattori, tipi, esempiAltri usi
I materiali generati da grafite, fluoro e MGF2 interleave.
L'Eutctic formato da NAF e MGF2 presenta proprietà di accumulo di energia nel calore latente, quindi è stato considerato per l'uso nei sistemi di energia solare.
Nell'area della biochimica, il fluoruro di magnesio, insieme ad altri fluoruri metallici, viene utilizzato per inibire le reazioni di trasferimento dei fosforili negli enzimi.
Recentemente, le nanoparticelle MGF2 sono state testate con successo come vettori di posizionamento dei farmaci nelle cellule malate per il trattamento del cancro.
Riferimenti
- Buckley, h.E. e Vernon, W.S. (1925) XCIV. La struttura cristallina del fluoruro di magnesio. Serie di riviste filosofiche 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica, Volume 11, quinta edizione, John Wiley & Sons. ISBN 0-471-52680-0 (V.undici).
- Peng, Minhong; Cao, weiping; e canzone, Jinhong. (2015). Preparazione della ceramica traslucida MGF2 mediante sinterizzazione a caldo. Journal of Wuhan University of Technology-Mater: SCI. Ed. Vol. 30 no. 4.
- Неieme, и.С. (2011). Magnesio al fluoruro. Fonte: proprio lavoro.
- Wojciechowska, Maria; Zielinski, Michal; e Piettowski, Mariusz. (2003). MGF2 come supporto per catalizzatore non congenziale. Journal of Florine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluoruro magnesio (MGF2). Consultato il 07/07/2019 in: Korth.Di
- Sevonkaev, Igor e Matijevic, Egon. (2009). Formazione di particelle di fluoro di magnesio di diverse morfologie. Langmuu 2009, 25 (18), 10534-10539.
- Неieme, и.С. (2013). Magnesio al fluoruro. Fonte: proprio lavoro.
- Tao Qin, Peng Zhang e Weiwei Qin. (2017). Un nuovo metodo per sintetizzare sfere di fluoruro di magnesio a basso costo dall'acqua di mare. Ceramics International 43 (2017) 14481-14483.
- La quinta edizione dell'Enciclopedia della chimica industriale (1996) di Ullmann. Volume A11. VCH Verlagsgellschaft MBH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingegneri che ispezionano lo specchio principale del telescopio spaziale Hubble 8109563. Fonte: mix.Msfc.vaso.Gov
- « Origine della scrittura pittografica, caratteristiche ed esempi
- Caratteristiche ed esempi di transazioni commerciali »

