Struttura di fluoruro di calcio (CAF2), proprietà, usi

- 4425
- 470
- Lidia Valentini
Lui fluoruro di calcio È un solido inorganico formato da un atomo di calcio (CA) e due atomi di fluoro (F). La sua formula chimica è CAF2 Ed è un solido bianco grigio cristallino.
In natura si trova nel minerale di fluorite o nel fluoro di schizzi. Esiste naturalmente in ossa e denti. Il minerale di fluorite è la fonte principale utilizzata per ottenere altri composti di fluoro.
 CAF Fluoruro di calcio2 solido. W: Utente: Walkerma nel giugno 2005. Fonte: Wikimedia Commons.
CAF Fluoruro di calcio2 solido. W: Utente: Walkerma nel giugno 2005. Fonte: Wikimedia Commons. Inoltre il caffè2 Viene utilizzato per la prevenzione della carie nei denti, quindi viene aggiunto ai materiali utilizzati dai dentisti per curarli. In effetti, il fluoruro di calcio viene anche aggiunto all'acqua potabile (acqua che può essere ubriaca) in modo che la popolazione beneficia quando si ingerisce e spazzola i denti.
CAF2 Viene utilizzato in grandi cristalli in attrezzatura ottica e telecamere. È anche usato in piccoli dispositivi che servono a rilevare quanto una persona è stata esposta alla radioattività.
[TOC]
Struttura
CAF Fluoruro di calcio2 È un composto ionico formato da un catione di calcio CA2+ e due fluoruro-. Tuttavia, alcune fonti di informazioni indicano che i loro collegamenti hanno un certo carattere covalente.
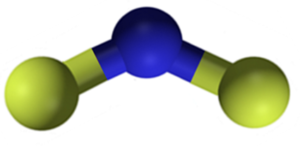 Struttura del fluoruro di calcio CAF2. Blu: calcio; Fluoro giallo. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Struttura del fluoruro di calcio CAF2. Blu: calcio; Fluoro giallo. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Nomenclatura
Fluoruro di calcio
Proprietà
Stato fisico
Colorazione da solido a bianco grigiastro con struttura cristallina cubica.
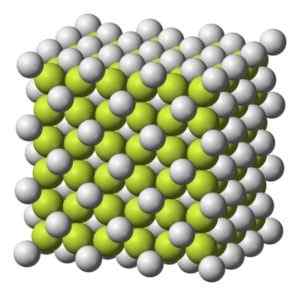 Struttura cubica cristallina del caffè2. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura cubica cristallina del caffè2. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Peso molecolare
78,07 g/mol
Punto di fusione
1418 ºC
Punto di ebollizione
2533 ºC
Densità
3,18 g/cm3 a 20 ° C.
Indice di rifrazione
1.4328
Solubilità
È insolubile in acqua a 20 ° C. Quasi insolubile a 25 ° C: 0,002 g/100 ml di acqua. Leggermente acido solubile.
Proprietà chimiche
Le sue proprietà ossidanti o riducenti sono molto deboli, tuttavia, queste reazioni possono verificarsi. Anche se, di solito, in pochissimi casi.
È inerte ai composti chimici organici e a molti acidi, incluso l'acido fluororico HF. Si dissolve lentamente in acido nitrico3.
Può servirti: Millikan Experiment: procedura, spiegazione, importanzaNon è infiammabile. Non reagisce rapidamente con aria o acqua.
A causa della sua piccola affinità per l'acqua, sebbene sia esposta ad un'alta percentuale di umidità, non la colpisce nemmeno per un mese a temperatura ambiente normale.
In presenza di umidità le pareti dei loro cristalli vengono lentamente sciolte a temperature superiori a 600 ° C. In ambienti asciutti può essere utilizzato fino a circa 1000 ° C senza gravemente colpiti.
Presenza in natura
CAF Fluoruro di calcio2 Si trova naturalmente nel minerale di fluorite o nel fluoruro di schizzi.
Anche se il caffè2 Pure è incolore, il minerale di fluorite è spesso colorato dalla presenza di elettroni intrappolati nei "fori" della struttura cristallina.
Questo minerale è molto apprezzato per la sua luminosità vetrosa e varietà di colori (viola, blu, verde, giallo, incolore, marrone, rosa, nero e arancione rossastro). Si dice che sia "il minerale più colorato del mondo".
 Florite di una miniera in Francia. Tolosa Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Florite di una miniera in Francia. Tolosa Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Florite (cristalli blu) del Museo naturale di Milano. Giovanni Dall'torto [CC BY-SA 2.5 It (https: // creativeCommons.Org/licenze/by-sa/2.5/It/Atto.In)]. Fonte: Wikimedia Commons.
Florite (cristalli blu) del Museo naturale di Milano. Giovanni Dall'torto [CC BY-SA 2.5 It (https: // creativeCommons.Org/licenze/by-sa/2.5/It/Atto.In)]. Fonte: Wikimedia Commons. Florite di una miniera in Inghilterra. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Florite di una miniera in Inghilterra. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Florite di una miniera in Francia. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Florite di una miniera in Francia. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
 Florite di una miniera negli Stati Uniti. Autore: Oliveira Jurema. Fonte: Wikimedia Commons.
Florite di una miniera negli Stati Uniti. Autore: Oliveira Jurema. Fonte: Wikimedia Commons. Il fluoro di calcio si trova anche nelle ossa in quantità tra lo 0,2 e lo 0,65%e anche nello smalto dei denti nello 0,33-0,59%.
Applicazioni
- Nel ottenere composti fluoruro
CAF di fluorita2 È la fonte di base o di maggioranza del fluoruro in tutto il mondo. È la materia prima per preparare quasi tutti i composti di fluoro.
Il più importante di questi è l'acido fluorhorico HF, da cui vengono preparati gli altri composti fluorici. Lo ione fluoruro f- Viene rilasciato dal minerale per reazione con acido solforico concentrato H2SW4:
Può servirti: isomeriaCAF2 (solido) + H2SW4 (liquido) → caso4 (solido) + 2 HF (gas)
- Nella cura dei denti
CAF Fluoruro di calcio2 È un agente per la prevenzione della carie. Viene utilizzato per fluire le acque bevibili (acque che possono essere bere) con questo obiettivo.
Inoltre, le basse concentrazioni di fluoro f- (dell'ordine di 0,1 parti per milione) utilizzati in paste dentifric e collutori hanno dimostrato di avere un profondo effetto positivo sulla cura dei denti preventiva della carie.
 Il fluoro di calcio aiuta nella prevenzione della carie. Autore: Annalise Batista. Fonte: Pixabay.
Il fluoro di calcio aiuta nella prevenzione della carie. Autore: Annalise Batista. Fonte: Pixabay. Nanoparticelle CAF2 più efficace
Sebbene i fluoruri siano usati in paste dentali e risciacquo, la bassa concentrazione di calcio (CA) nella saliva provoca i depositi di caffè non2 Nei denti nel modo più efficace possibile.
Ecco perché è stato ideato un modo per ottenere polvere di caffè2 come nanoparticelle.
Per questo un essiccatore viene utilizzato da Rocío (dall'inglese -Asciugacaprista) Dove due soluzioni (una di ca (OH) idrossido di calcio2 e uno di fluoruro di ammonio NH4F) si mescolano mentre vengono spruzzati in una fotocamera con flusso di aria calda.
Quindi si verifica la seguente reazione:
Ca (Oh)2 + NH4F → CAF2 (solido) + NH4OH
Il NH4Oh volatilizza come NH3 e h2O e le nanoparticelle CAF rimangono2.
Questi hanno un'elevata reattività e una maggiore solubilità, il che li rende più efficaci per la seineralizzazione dei denti e come anticarie.
- In obiettivo per attrezzatura ottica
Il fluoro di calcio viene utilizzato per costruire elementi ottici come prismi e spettrofotometri della luce a infrarossi e ultravioletti (UV).
Questi dispositivi consentono di misurare la quantità di luce assorbita da un materiale quando passa attraverso di esso.
CAF2 È trasparente in queste regioni dello spettro della luce, ha un indice di rifrazione estremamente basso e consente di ottenere una risoluzione più efficiente di quella del NaCl nell'intervallo 1500-4000 cm-1.
Può servirti: paramegnetismoGrazie alla sua stabilità chimica può supportare condizioni avverse in modo che gli elementi ottici del CAF2 Non sono attaccati. Ha anche un'alta durezza.
Nelle telecamere
Alcuni produttori di fotocamere utilizzano lenti da caffè2 artificiale cristallizzato per ridurre la dispersione della luce e ottenere un'eccellente correzione della distorsione dei colori.
 Alcune telecamere hanno lenti a fluoro di calcio CAF2 Per ridurre la distorsione dei colori. Bill Ebbesen [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons.
Alcune telecamere hanno lenti a fluoro di calcio CAF2 Per ridurre la distorsione dei colori. Bill Ebbesen [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)]. Fonte: Wikimedia Commons. - Nell'industria metallurgica
CAF2 È usato come agente fondatore nell'industria metallurgica, perché è una fonte di calcio insolubile in acqua e quindi efficace nelle applicazioni sensibili all'ossigeno.
Viene utilizzato per sciogliere ed elaborare ferro e acciaio. Questo si basa sul fatto che ha un punto di fusione simile a quello del ferro e anche che può dissolvere ossidi e metalli.
- In rilevatori di radioattività o radiazioni pericolose
CAF2 È un materiale termoluminescente. Ciò significa che può assorbire le radiazioni negli elettroni della sua struttura cristallina e quindi quando viene riscaldato per rilasciarla sotto forma di luce.
Questa luce emessa può essere misurata da un segnale elettrico. Questo segnale è proporzionale alla quantità di radiazioni ricevute dal materiale. Significa che maggiore è la quantità di radiazioni, maggiore è la quantità di luce che verrà emessa in seguito quando riscaldata.
Pertanto il CAF2 È usato nei due imimetri personali così chiamati, che sono usati da persone che sono esposte a radiazioni pericolose e si desidera sapere quante radiazioni hanno ricevuto in un periodo di tempo.
- Altri usi
- È usato come catalizzatore nelle reazioni chimiche di disidratazione e deidrogenazione per la sintesi di composti organici.
- È usato negli elettrodi alcalini della saldatura. Si ottiene una saldatura più forte che con elettrodi acidi. Questi elettrodi sono utili nella produzione di navi e contenitori in acciaio ad alta pressione.
- Come integratore alimentare in quantità estremamente basse (ppm o parti per milione).
 Saldatura uomo. Elettrodi con caffè fluoruro di calcio2 Formano saldature più forti. William m. Plate jr. [Dominio pubblico]. Fonte: Wikimedia Commons.
Saldatura uomo. Elettrodi con caffè fluoruro di calcio2 Formano saldature più forti. William m. Plate jr. [Dominio pubblico]. Fonte: Wikimedia Commons. Riferimenti
- Pirmradian, m. e Hooshmand, t. (2019). Remineralizzazione e capacità antibatteriche di nanocompositi dentali a base di resina. Sintesi e caratterizzazione del fluoruro di calcio (CAF2). In applicazioni di materiali nanocompositi in odontoiatria. Recuperato da ScienceDirect.com.
- O.S. Biblioteca nazionale di medicina. (2019). Calcio di fluoro. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Weman, k. (2012). Saldatura manuale dell'arco metallico (MMA) con elettrodi rivestiti. Nel manuale dei processi di saldatura (seconda edizione). Recuperato da ScienceDirect.com.
- Hanning, m. e Hanning, C. (2013). Nanobiomateriali in odontoiatria preventiva. Calcio di fluoro nanosizzato. In nanobiomateriali in odontoiatria clinica. Recuperato da ScienceDirect.com.
- Ropp, r.C. (2013). Gruppo 17 (h, f, cl, br, i) composti terrestri alcalini. Calcio di fluoro. Nell'enciclopedia dei composti terrestri alcalini. Recuperato da ScienceDirect.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Valkovic, v. (2000). Misurazioni della radioattività. In radioattività nell'ambiente. Rilevatori temiluminescenti (TLDS). Recuperato da ScienceDirect.com.
- « Struttura, Proprietà, Ottenimento, Ottenimento, Ottenimento, Ottenimento
- Struttura di ossido di silicio (SIO2), proprietà, usi, ottenendo »

