Fattori che influenzano la solubilità
- 1296
- 168
- Lino Lombardi
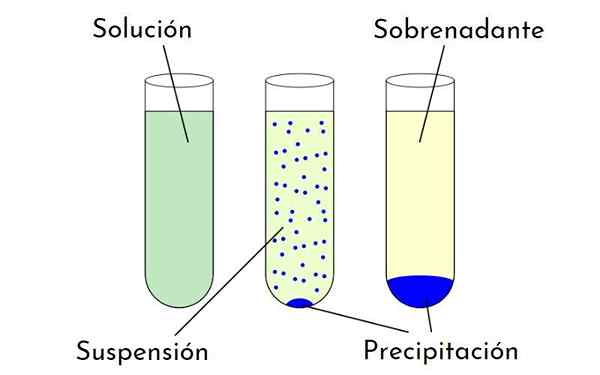
 Diagramma che mostra le differenze tra una soluzione, una sospensione e una precipitazione che forma un precipitato e un surnatante. Fonte: Zabmilenko: Orninalzofari: Vectormrmw: ottimizzato, Multilang, Wikimedia Commons
Diagramma che mostra le differenze tra una soluzione, una sospensione e una precipitazione che forma un precipitato e un surnatante. Fonte: Zabmilenko: Orninalzofari: Vectormrmw: ottimizzato, Multilang, Wikimedia Commons Quali sono i fattori che influenzano la solubilità?
Principale fattori che influenzano la solubilità Sono polarità, effetto dello ione comune, temperatura, pressione, natura del soluto e fattori meccanici. La solubilità è la capacità di un chimico solido, liquido o gassoso (chiamato soluto) di dissolversi nel solvente (di solito un liquido) e formare una soluzione.
La solubilità di una sostanza dipende fondamentalmente dal solvente utilizzato, nonché dalla temperatura e dalla pressione. La solubilità di una sostanza in un particolare solvente viene misurata dalla concentrazione della soluzione satura.
Una soluzione è considerata satura quando l'aggiunta di soluto aggiuntivo non aumenta più la concentrazione della soluzione.
Il grado di solubilità varia ampiamente a seconda delle sostanze, da infinitamente solubili (completamente miscibili), come l'etanolo in acqua, fino a poco solubile, come cloruro d'argento in acqua. Il termine "insolubile" spesso si applica ai piccoli composti solubili.
Alcune sostanze sono solubili in tutte le proporzioni con un determinato solvente, come l'etanolo in acqua. Questa proprietà è conosciuta come Malibilità.
In varie condizioni, la solubilità di equilibrio può essere superata per fornire una soluzione chiamata Supersaturata.
Fattori principali che influenzano la solubilità
1. Polarità
Nella maggior parte dei casi, i soluti si dissolvono in solventi che hanno una polarità simile. I chimici usano un aforismo popolare per descrivere questa caratteristica di soluti e solventi: "simile dissolve simile".
I soluti non polari non si dissolvono nei solventi polari e viceversa.
2. Effetto ione comune
L'effetto ione comune è un termine che descrive la diminuzione della solubilità di un composto ionico quando un sale contiene uno ione che già esiste nell'equilibrio chimico viene aggiunto alla miscela.
Questo effetto è meglio spiegato dal principio di Le Châtelier. Immagina se il solfato di calcio composto leggermente solubile, Case4, Viene aggiunto all'acqua. L'equazione ionica netta per l'equilibrio chimico risultante è la seguente:
Case4 (s) ⇌CA2+(aq)+SO42− (aq)
Il solfato di calcio è leggermente solubile. In equilibrio, la maggior parte del calcio e del solfato esistono solidamente di solfato di calcio.
Può servirti: acido iaridrico (HI): struttura, proprietà e usiSupponiamo che il solfato di rame solubile in composto ionico (CUO4) È stato aggiunto alla soluzione. Il solfato di rame è solubile. Pertanto, il suo unico effetto importante sull'equazione ionica netta è l'aggiunta di più ioni solfato (quindi42-).
CUSO4 (S) ⇌CU2+(aq)+SO42− (aq)
Gli ioni solfato dissociati di solfato di rame sono già presenti (comune a) nella miscela dalla leggera dissociazione del solfato di calcio.
Pertanto, questa aggiunta di ioni solfato sottolinea l'equilibrio precedentemente stabilito.
Il principio di Le Catetier impone che lo sforzo aggiuntivo su questo lato del prodotto del bilancia si traduca nel cambio di equilibrio al lato dei reagenti per alleviare questa nuova tensione.
A causa della modifica del lato reagente, la solubilità solubile di solfato di calcio è ulteriormente ridotta.
3. Temperatura
La temperatura ha un effetto diretto sulla solubilità. Per la maggior parte dei solidi ionici, l'aumento della temperatura aumenta la velocità con cui è possibile effettuare la soluzione.
All'aumentare della temperatura, le particelle solide si muovono più velocemente, il che aumenta le possibilità di interagire con più particelle di solvente. Ciò si traduce in aumento della velocità con cui si verifica una soluzione.
La temperatura può anche aumentare la quantità di soluto che può essere sciolta in un solvente. In termini generali, all'aumentare della temperatura, si dissolvono più particelle di soluto.
Ad esempio, quando lo zucchero viene aggiunto all'acqua, è un metodo facile per creare una soluzione. Quando quella soluzione viene riscaldata e lo zucchero viene ancora aggiunto, si scopre che si possono aggiungere grandi quantità di zucchero man mano che la temperatura continua ad aumentare.
Il motivo per cui ciò accade è che all'aumentare della temperatura, le forze intermolecolari possono essere spezzate più facilmente, consentendo di attrarre più particelle di soluto.
Può servirti: magnesio: storia, struttura, proprietà, reazioni, usiCi sono altri esempi, tuttavia, in cui l'aumento della temperatura ha un effetto molto scarso sulla quantità di soluto che può essere sciolto.
Il sale da tavola è un buon esempio: puoi dissolvere quasi la stessa quantità di sale da tavola in acqua ghiacciata che puoi in acqua bollente.
Per tutti i gas, all'aumentare della temperatura, la solubilità diminuisce. La teoria molecolare cinetica può essere usata per spiegare questo fenomeno.
All'aumentare della temperatura, le molecole di gas si muovono più velocemente e sono in grado di sfuggire al liquido. La solubilità del gas, quindi, diminuisce.
4. Pressione
Il quarto fattore, la pressione, influisce sulla solubilità di un gas in un liquido, ma mai di un solido che si dissolve in un liquido.
Quando la pressione viene applicata a un gas che si trova sopra la superficie di un solvente, il gas si sposterà sul solvente e occuperà alcuni degli spazi tra le particelle di solvente.
Un buon esempio è la soda gassata. La pressione viene applicata per forzare le molecole di co₂ nella soda. È anche vero il contrario. Quando la pressione del gas diminuisce, anche la solubilità di quel gas diminuisce.
Quando si apre una bevanda di bibite, la pressione nella soda viene abbassata, quindi il gas inizia immediatamente a uscire dalla soluzione.
L'anidride carbonica immagazzinata nella soda viene rilasciata e puoi vedere effervescenza sulla superficie liquida. Se una lattina aperta di soda viene lasciata per un periodo di tempo, possiamo notare che la bevanda diventa piatta a causa della perdita di anidride carbonica.
Questo fattore di pressione del gas è espresso nella legge di Henry. La legge di Henry stabilisce che, a una data temperatura, la solubilità di un gas in un liquido è proporzionale alla pressione parziale del gas sul liquido.
Può servirti: soluzioni normali: concetto, preparazione, esempiUn esempio della legge di Henry è prodotto nell'immersione. Quando una persona si immerge in acque profonde, la pressione aumenta e più gas si dissolvono nel sangue.
Mentre si alza dalle acque profonde, il sub deve tornare in superficie a una velocità molto lenta per consentire a tutti i gas disciolti di lasciare il sangue molto lentamente.
Se una persona sale troppo velocemente, può verificarsi un'emergenza medica a causa dei gas che escono dal sangue troppo velocemente.
5. Natura del soluto
La natura del soluto e il solvente e la presenza di altri composti chimici nella soluzione influiscono sulla solubilità.
Ad esempio, puoi dissolvere una maggiore quantità di zucchero in acqua, che esce in acqua. In questo caso, si dice che lo zucchero sia più solubile.
L'etanolo in acqua è completamente solubile tra loro. In questo caso particolare, il solvente sarà il composto che è in maggiore quantità.
La dimensione del soluto è anche un fattore importante. Più grandi sono le molecole del soluto, maggiore è il suo peso molecolare e le sue dimensioni. È più difficile per le molecole di solvente circondare molecole più grandi.
Se tutti i fattori di cui sopra sono esclusi, si può scoprire una regola generale che le particelle più grandi sono generalmente meno solubili.
Se la pressione e la temperatura sono uguali tra due soluti della stessa polarità, quello con particelle più piccole è generalmente più solubile.
6. Fattori meccanici
Contrariamente alla velocità della soluzione, che dipende principalmente dalla temperatura, la velocità di ricristallizzazione dipende dalla concentrazione di soluto dalla superficie della rete cristallina, un caso che viene favorito quando una soluzione è immobile.
Pertanto, l'agitazione della soluzione evita questo accumulo, massimizzando la soluzione.
Riferimenti
- Solubilità. Recuperato dai legli.com.
- Fattori che affrettano la solubilità. Recuperato da CK12.org.
- Educare online (s.F.). Fattori che affrettano la solubilità. Estratto da solubilità.com.

