Fattore di compressibilità come calcolare, esempi ed esercizi
- 1652
- 92
- Enzo De Angelis
Lui Fattore di compressibilità z, o Fattore di compressione per i gas, è un valore senza dimensioni (senza unità) che viene introdotto come una correzione nell'equazione dello stato di gas ideale. In questo modo il modello matematico ricorda di più il comportamento osservato del gas.
Nel gas ideale, l'equazione statale che si riferisce alle variabili P (pressione), V (volume) e T (temperatura) è: P.V ideale = n.R.T con n = numero di moli e r = costante dei gas ideali. Aggiungendo la correzione del fattore di compressione Z, questa equazione viene trasformata in:
P.V = z.N.R.T
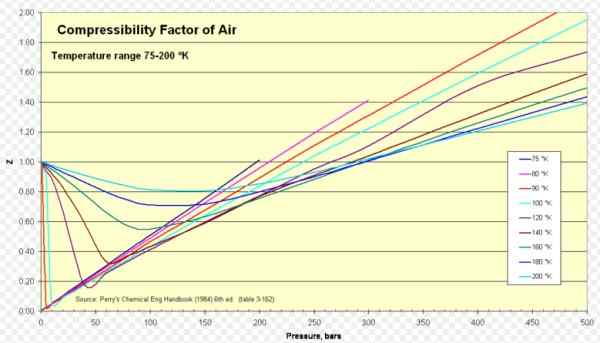
 Figura 1. Fattore di compressibilità dell'aria. Fonte: Wikimedia Commons. https: // caricamento.Wikimedia.Org/Wikipedia/Commons/8/84/Compressibility_Factor_of_Air_75-200_K.Png.
Figura 1. Fattore di compressibilità dell'aria. Fonte: Wikimedia Commons. https: // caricamento.Wikimedia.Org/Wikipedia/Commons/8/84/Compressibility_Factor_of_Air_75-200_K.Png. [TOC]
Come calcolare il fattore di compressibilità?
Tenendo conto del fatto che il volume molare è VFreddo = V/N, Hai il vero volume molare:
P . Vvero = Z. R. T → z = pv vero/Rt
Poiché il fattore di compressibilità Z dipende dalle condizioni del gas, è espresso in funzione della pressione e della temperatura:
Z = z (p, t)
Confrontando le prime due equazioni, si nota che se il numero di moli N è uguale a 1, il volume molare di un gas reale è correlato a quello del gas ideale attraverso:
Vvero / Videale = Z → V vero = Z videale
Quando la pressione supera le 3 atmosfere, la maggior parte dei gas smette di comportarsi come gas ideali e il volume reale differisce significativamente dall'ideale.
Ciò ha realizzato nei suoi esperimenti il fisico olandese Johannes van der Waals (1837-1923), che lo ha portato a creare un modello che si adattava meglio ai risultati pratici rispetto all'equazione dei gas ideali: l'equazione statale di van der Waals.
Può servirti: ossalato di sodio (Na2c2o4): struttura, proprietà, usi, rischiEsempi
Secondo l'equazione P.Vvero= Z.N.Rt, Per un gas ideale, z = 1. Tuttavia, nei gas reali, aumentando la pressione fa anche il valore di z. Questo ha senso perché a maggiore pressione le molecole di gas hanno più opportunità di scontrarsi, quindi le forze di repulsione aumentano e quindi il volume.
D'altra parte per ridurre le pressioni, le molecole si muovono con maggiore libertà e le forze di repulsione diminuiscono. Pertanto è previsto un volume inferiore. Per quanto riguarda la temperatura, quando aumenta, Z diminuisce.
Come ha osservato van der Waals, nelle vicinanze del punto critico così chiamato, il comportamento del gas è molto deviato da un gas ideale.
Il punto critico (tC, PC) di qualsiasi sostanza sono i valori di pressione e temperatura che determinano il loro comportamento prima di un cambio di fase:
-TC È la temperatura al di sopra della quale il gas in questione non è liquefatto.
-PC È la pressione minima richiesta per liquefare il gas a temperatura tC
Ogni gas ha il suo punto critico, tuttavia, che definisce la temperatura e la ridotta pressione TR E pR come segue:
PR = P / pC
VR = V /vC
TR = T /tC
Si osserva che un gas confinato con identico VR E TR esercitare la stessa pressione PR. Per questo motivo, se Z è grafico a seconda PR allo stesso TR, Ogni punto di quella curva è lo stesso per qualsiasi gas. Questo è chiamato Principio degli stati corrispondenti.
Il fattore di compressibilità in gas ideali, aria, idrogeno e acqua
Di seguito è una curva di compressibilità per vari gas a diverse temperature ridotte. Quindi alcuni esempi di z per alcuni gas e una procedura per trovare z usando la curva.
Può servirti: idrogeno: storia, struttura, proprietà e usi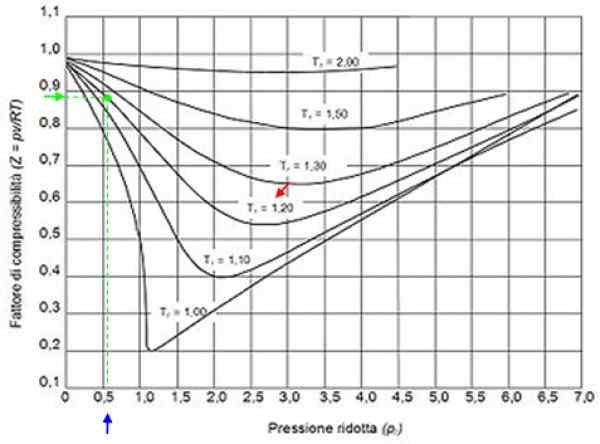 figura 2. Grafica grafica per i gas grafici in base alla pressione di riduzione. Fonte: Wikimedia Commons.
figura 2. Grafica grafica per i gas grafici in base alla pressione di riduzione. Fonte: Wikimedia Commons. Gas ideali
I gas ideali hanno z = 1, come spiegato all'inizio.
Aria
Perché l'aria Z è circa 1 in una vasta gamma di temperature e pressioni (vedi Figura 1), dove il modello di gas ideale fornisce risultati molto buoni.
Idrogeno
Z> 1 per tutte le pressioni.
Acqua
Per trovare z dell'acqua, sono necessari i valori del punto critico. Il punto critico dell'acqua è: PC = 22.09 MPA e TC= 374.14 ° C (647.3 k). Ancora una volta è necessario tenere conto del fatto che il fattore di compressibilità Z dipende dalla temperatura e dalla pressione.
Ad esempio, supponiamo di voler trovare z dall'acqua a 500 ºC e 12 MPa. Quindi il primo è calcolare la temperatura ridotta, per la quale i gradi Celsius devono essere passati a Kelvin: 50 ºC = 773 K:
TR = 773/647.3 = 1.2
PR = 12/22.09 = 0.54
Con questi valori che localizziamo nel grafico della figura la curva corrispondente a tR = 1.2, indicato con una freccia rossa. Quindi guardiamo nell'asse orizzontale il valore di PR più vicino a 0.54, contrassegnato in blu. Ora disegniamo una verticale fino a quando non intercetta la curva tR = 1.2 e infine è proiettato da quel punto all'asse verticale, dove leggiamo il valore approssimativo di z = 0.89.
Esercizi risolti
Esercizio 1
C'è un campione di gas a una temperatura di 350 K e una pressione di 12 atmosfere, con un volume molare più alto del 12 % rispetto al previsto dalla legge ideale sui gas. Calcolare:
a) fattore di compressione z.
b) volume molare di gas.
Può servirti: reazione irreversibile: caratteristiche ed esempic) Secondo i risultati di cui sopra, indicare quali sono le forze dominanti in questo campione di gas.
Dati: r = 0,082 L.ATM/mol.K
Soluzione a
Sapendo che v vero è più alto del 12 % rispetto a Videale :
Vvero = 1.12videale
Z = v vero / Videale = 1.12
Soluzione b
P . Vvero = Z. R. T → Vvero = (1.12 x 0.082 x 350 /12) l /mol = 2.14 l/mol.
Soluzione c
Le forze di repulsione sono quelle che predominano, poiché il volume del campione è aumentato.
Esercizio 2
Ci sono 10 moli di etano confinati in un volume di 4.86 L a 27 ºC. Trova la pressione esercitata dall'etano da:
a) Il modello di gas ideale
b) l'equazione di van der Waals
c) Trova il fattore di compressione dai risultati precedenti.
Dati per etano
Coefficienti di Van der Waals:
A = 5.489 dm6. ATM . mol-2 e b = 0.06380 DM3. mol-1.
Pressione critica: 49 atm. Temperatura critica: 305 K
Soluzione a
La temperatura viene passata a Kelvin: 27 º C = 27 +273 K = 300 K, ricorda anche che 1 litro = 1 l = 1 dm3.
Quindi i dati forniti nell'equazione del gas ideale vengono sostituiti:
P.V = n.R.T → P = (10 x 0,082 x 300/4.86 l) atm = 50.6 atm
Soluzione b
L'equazione dello stato di Van der Waals è:
Dove a e b sono i coefficienti forniti dalla dichiarazione. Quando si cancella P:
Soluzione c
Calcoliamo la pressione e la temperatura ridotte:
PR = 35.2/49 = 0.72
TR = 300/305 = 0.98 ≈ 1
Con questi valori, si cerca il valore di z nel grafico della Figura 2, scoprendo che Z è circa 0.7.
Riferimenti
- Atkins, p. 1999. Chimica fisica. Omega Editions.
- Cengel, e. 2012. Termodinamica. 7Ma Edizione. McGraw Hill.
- Engel, t. 2007. Introduzione alla fisicoChimica: Termodinamica. Pearson.
- Levine, i. 2014. Principi di fisica-chimica. 6 °. Edizione. McGraw Hill.
- Wikipedia. Fattore di compressibilità. Recuperato da: in.Wikipedia.org.

