Struttura, proprietà, usi, effetti di etanamide
- 4906
- 109
- Cosetta Messina
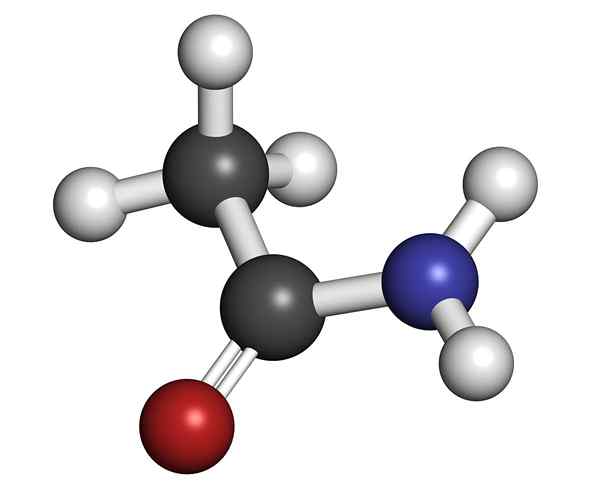
IL etanamide È una sostanza chimica che appartiene al gruppo di composti organici di azoto. Si chiama anche acetamide, secondo l'Unione Internazionale della Chimica Pura e Applicata (IUPAC). Commercialmente si chiama acido acetico.
Si chiama Amida perché l'azoto è collegato a un gruppo carbonilico. È primario, perché mantiene i due atomi di idrogeno uniti a azoto -nh2. È stato trovato in natura come minerale solo nel tempo secco; Nella stagione piovosa o molto umida si dissolve nell'acqua.
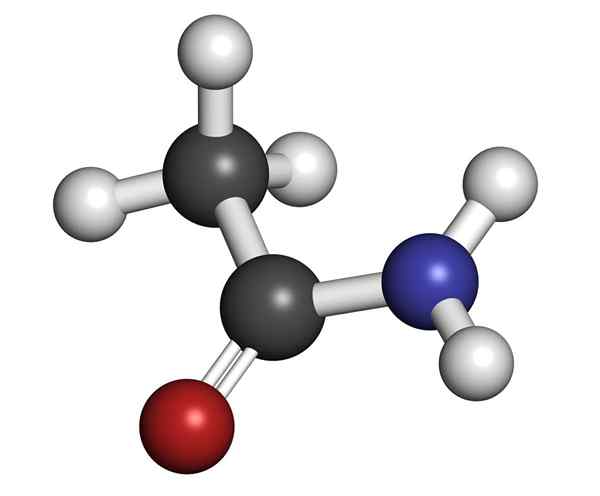 Struttura molecolare dell'acetamide
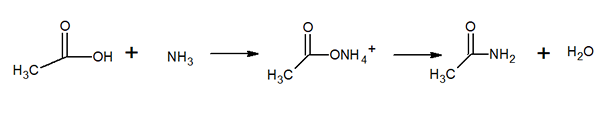
Struttura molecolare dell'acetamide È un solido vetroso (trasparente). Il suo colore va da incolore al grigio, forma piccoli stalattiti e talvolta aggregati granulari. Può verificarsi con la reazione tra acido acetico e ammoniaca, formando un sale intermedio: acetato di ammonio. Quindi questo è disidratato per produrre Amida e formare acqua:
[TOC]
Struttura chimica
La struttura chimica interna del cristallo di acetamide è trigonale, ma quando si unisce per formare agglomerati acquisisce una forma ottaedrica.
La formula strutturale del composto è costituita da un gruppo di acetil e un gruppo amminico:
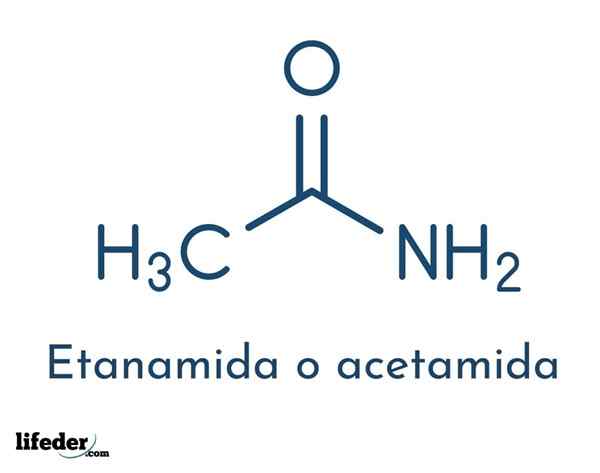
Questi gruppi consentono le diverse reazioni che il composto può essere eseguito. La formula molecolare dell'acetamide è C2H5NO.
Proprietà fisiche dell'etanamide
Aspetto | Sono cristalli che vanno da incolori al grigio. |
Odore | Gabinetto. Quando ha impurità, ha un odore di ammoniaca-urea. |
Idea | Può essere trovato in natura, oltre alle miniere nelle radici della barbabietola da zucchero, nel vino che si è ossidato in eccesso e nel fumo del tabacco. |
Massa molare | 59.07 g/ml |
Densità dell'acqua | 1.159 g/cm³ |
Punto di fusione | Tra un intervallo di 79 ° C-81 ° C |
Punto di ebollizione | 221 ° C |
Solubilità dell'acqua, etanolo, piridina, cloroformio, glicerolo e benzene | Molto solubile |
Pressione del vapore | 1.3x10-5 atm. |
Proprietà chimiche
Le proprietà chimiche di una sostanza si riferiscono alla loro reattività quando sono in presenza di altri che possono causare trasformazione nella sua struttura. Acetamide presenta le seguenti reazioni:
Può servirti: Faraday CostantAcido e idrolisi di base
Nell'idrolisi acida reagisce con acido inorganico ad alta temperatura per formare acido carbossilico e sale di ammonio.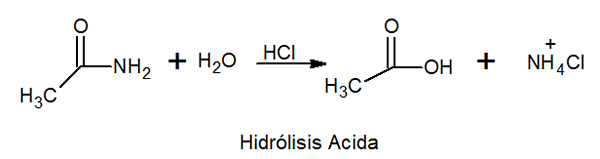
Nell'idrolisi di base, si verifica il sale di metallo e ammoniaca.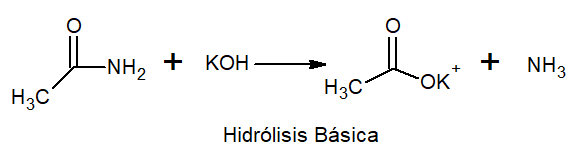
Riduzione
Riduzione significa guadagno di idrogeno, quindi questa reazione produce un'ammina primaria chiamata etanamina o etilammina. Il riduttore è idruro di litio e liale di alluminio4. 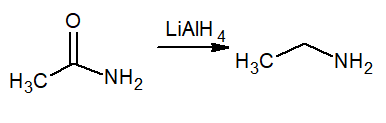
Disidratazione
Questo termine indica la perdita di acqua dalla molecola. Sono usati come reagenti disidratante tionilo cloruro (SOCL2) o pentossido di fosforo (P2O5). Il prodotto finale è un nitrile. 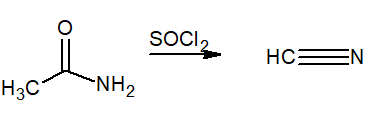
Nel campo industriale, la produzione di acidi carbossilici è molto vantaggiosa a causa dell'importanza dei suoi derivati. Tuttavia, ottenere acido etano dall'acetamide ha un'applicazione molto limitata, poiché le alte temperature a cui si verifica il processo tendono a abbattere l'acido.
In laboratorio, sebbene l'etanamide possa essere ottenuta dall'acido acetico, la riconversione di un'ammide acida è molto improbabile, e questo è generalmente per tutte le ammidi.
Può servirti: ititrium: struttura, proprietà, usi, ottenendoUsi di acetamide
L'acetamide si è verificata commercialmente dal 1920, sebbene non sia certo che fino ad oggi sia in uso commerciale. In precedenza era usato per la sintesi di metilammina, tioacetamide, ipnotici, insetticidi e per scopi medicinali.
L'acetamide è un composto che, nel campo industriale, è usato come:
- Plamiting, in pelle, film in tessuto e rivestimenti.
- Additivo cartaceo, per dare resistenza e flessibilità.
- Denaturazione degli alcoli. Viene aggiunto all'alcool nello studio per rimuovere parte della purezza che ha e quindi può servire altri usi, come il solvente.
- Lacca, per brillare sulle superfici e/o per proteggere i materiali dalle aggressioni dell'ambiente, in particolare la corrosione.
- Esplosivo.
- Fondatore, da quando viene aggiunto a una sostanza facilita la fusione di questo.
- In crioscopia.
- Come intermedio nell'elaborazione di farmaci come l'ampicillina e gli antibiotici derivati da cefalosporine, come: mal di testa, cefalexina, calore, malleato enalapril (trattamento di ipertensione) e sulfacetamide (antimicrobici Ofilamiche), tra gli altri).
- Solvente, poiché alcune sostanze aumentano la solubilità in acqua quando l'acetamide viene sciolta in esso.
- Come solvente che fissa i coloranti nel settore tessile.
- Nell'elaborazione della metilammina.
- Come biocidio, nei composti che possono essere usati come disinfettanti, conservanti, pesticidi, ecc.
Effetti sulla salute
Nelle industrie chimiche in cui l'acetamide viene utilizzata come solvente e plastificante, i lavoratori possono presentare irritazione della pelle a causa di acuta (esposizione a breve termine) dalla presenza di questi composti.
Non ci sono informazioni sugli effetti cronici (a lungo termine) o sullo sviluppo cancerogeno nell'uomo. Secondo l'Agenzia per la protezione ambientale degli Stati Uniti (EPA), l'acetamide non è classificata come cancerogena.
Può servirti: nessun elettroliti: caratteristiche ed esempiL'Agenzia internazionale per la ricerca sul cancro ha classificato l'acetamide come gruppo 2b, possibile cancerogeno umano.
La California Environmental Protection Agency ha stabilito una stima del rischio di inalazione di 2 × 10-5 µg/m3 (microgramma per metro cubo) e un rischio di cancro orale dopo ingestione 7 × 10-2 mg/kg/d (milligrammi per ogni chilogrammo in un giorno).
Tuttavia, sebbene la popolazione generale possa essere esposta al fumo di sigarette o contatti cutanei con prodotti contenenti acetamide, non rappresenta molti rischi a causa delle caratteristiche della solubilità e dell'igroscopia che ha con l'acqua.
Può essere facilmente spostato dal terreno attraverso il deflusso, ma dovrebbe essere degradato dai microrganismi e non accumulare nei pesci.
L'acetamide è una leggera pelle e occhi irritanti e non ci sono dati disponibili che certificano i suoi effetti tossici sull'uomo.
Negli animali di laboratorio è stata osservata tossicità nella perdita di peso corporeo quando è soggetto a una dose orale molto elevata nel tempo. Tuttavia, non sono stati osservati aborti o effetti dannosi nella nascita dei giovani dei genitori trattati con acetamide.
Riferimenti
- Cosmos Online, (dal 1995), Informazioni tecniche e commerciali di Acetamide, recuperato il 23 marzo 2018, Cosmos.com.MX
- Morrison, r., Boyd, r., (1998), Chimica organica (5a edizione), Messico, Fondo educativo inter -americano, s.A de c.V
- Pino, s., Hammond, g., Cram, d., Hendrickson, J., (1982). Chimica organica, (seconda edizione), Messico, McGraw-Hill de México, s.A de c.V
- Guida chimica, (2013), usi dell'acetamide, recuperato il 24 marzo 2018, Guiadeproductosquimicos.Blogspot.com.co
- Centro nazionale per le informazioni sulla biotecnologia. Database composto pubchem; CID = 178, acetamide. PUBCHEM recuperato.NCBI.Nlm.NIH.Gov

