Spettro di assorbimento

- 3212
- 862
- Kayla Serr
 Spettro di luce visibile. Fonte: Wikimedia Commons
Spettro di luce visibile. Fonte: Wikimedia Commons Cos'è uno spettro di assorbimento?
UN Spettro di assorbimento È il prodotto dell'interazione della luce con un materiale o una sostanza in uno qualsiasi dei suoi stati fisici. L'interazione include un ampio segmento dell'intervallo di lunghezze d'onda e energia delle radiazioni elettromagnetiche.
In altre parole, lo spettro di assorbimento riflette quella frazione di radiazione elettromagnetica che un determinato materiale si assorbe in un intervallo di frequenza.
In questo senso, alcuni solidi, liquidi o gas possono assorbire fotoni di diverse energie o lunghezze d'onda, dalle radiazioni ultraviolette, seguite da luce visibile, a radiazioni o luce a infrarossi, sbalorditive nelle lunghezze d'onda a microonde.
L'occhio umano percepisce solo le interazioni della materia con luce visibile. È anche in grado di contemplare la diffrazione della luce bianca attraverso un prisma o un mezzo nei suoi componenti colorati (immagine superiore).
Se il raggio di luce viene "cattura" dopo aver viaggiato attraverso un materiale e analizzato, si trova l'assenza di alcune bande colorate. Cioè, le strisce nere verrebbero osservate in contrasto con il suo sfondo.
Questo è lo spettro di assorbimento e la sua analisi è fondamentale per la chimica analitica strumentale e l'astronomia.
Assorbimento atomico
Nell'immagine superiore viene mostrato uno spettro di assorbimento tipico degli elementi o degli atomi. Si noti che le strisce nere rappresentano le lunghezze d'onda assorbite, mentre le altre vengono emesse. Ciò significa che, al contrario, uno spettro di trasmissione atomica sembrerebbe una banda nera con i colori emessi.
Ma quali sono quelle strisce? Come sapere se gli atomi assorbono o emettono (senza introdurre fluorescenza o fosforescenza)? Le risposte sono negli stati elettronici consentiti dagli atomi.
Può servirti: formula minima: come ottenere la formula minima, esempi ed eserciziTransizioni elettroniche ed energia
Gli elettroni sono in grado di allontanarsi dal nucleo, lasciandolo caricato positivamente mentre viaggiano da un orbitale di energia inferiore a una maggiore energia. Per fare questo, spiegato dalla fisica quantistica, assorbire fotoni di energia specifica per eseguire detta transizione elettronica.
Pertanto, l'energia è quantizzata e non assorbirà il mezzo o tre quarti di un fotone, ma i valori di frequenza (ν) o le lunghezze d'onda del calcestruzzo (λ).
Una volta eccitato l'elettrone, non rimane illimitato nello stato elettronico di maggiore energia. Rilasciare energia sotto forma di un fotone e l'atomo ritorna al suo stato basale o originale.
A seconda che siano registrati fotoni assorbiti, ci sarà uno spettro di assorbimento. E se vengono registrati i fotoni emessi, il risultato sarà uno spettro di emissione.
Questo fenomeno può essere osservato sperimentalmente se campioni morbidi o atomizzati vengono riscaldati da un elemento. In astronomia, confrontando questi spettri, la composizione di una stella può essere nota e persino la sua posizione relativa alla terra.
Spettro visibile
Come si può vedere nell'immagine, lo spettro visibile include i colori dal viola al rosso e tutte le sue tonalità rispetto a quanto il materiale si assorbe (sfumature scure).
Le lunghezze d'onda della luce rossa corrispondono a valori di 650 nm in avanti (fino a scomparire nelle radiazioni a infrarossi).
E sull'estremità sinistra, i toni viola e viola coprono i valori della lunghezza d'onda fino a 450 nm. Lo spettro visibile copre quindi da 400 a circa 700 nm.
All'aumentare di λ, la frequenza del fotone diminuisce e, quindi, la sua energia. Pertanto, la luce viola ha una maggiore energia (lunghezze d'onda più basse) rispetto alla luce rossa (lunghezze d'onda più elevate).
Può servirti: bromo: storia, struttura, configurazione elettronica, proprietà, usiPertanto, un materiale che assorbe la luce viola implica transizioni elettroniche di maggiori energie.
Quando il materiale assorbe il colore viola, indosserà un colore giallo verdastro, il che significa che i suoi elettroni eseguono transizioni di energia molto. E quando il materiale assorbe il colore rosso, di meno energia, rifletterà un colore verde bluastro.
Quando un atomo è molto stabile, di solito presenta stati elettronici molto distanti in energia e quindi dovrà assorbire fotoni di maggiore energia per consentire transizioni elettroniche:
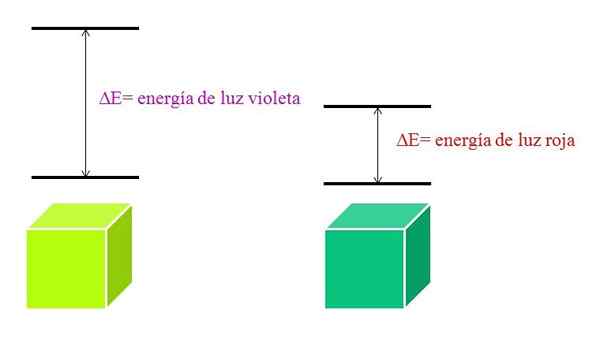 Schema delle energie della luce viola e della luce rossa. Fonte: Gabriel Bolívar
Schema delle energie della luce viola e della luce rossa. Fonte: Gabriel Bolívar Spettro di assorbimento delle molecole
Le molecole hanno atomi e queste assorbono anche le radiazioni elettromagnetiche. Tuttavia, i loro elettroni fanno parte del legame chimico, quindi le loro transizioni sono diverse. Uno dei grandi trionfi della teoria orbitale molecolare è essere in grado di mettere in relazione gli spettri di assorbimento con la struttura chimica.
Pertanto, collegamenti semplici, doppi, tripli, coniugati e strutture aromatiche, hanno i loro stati elettronici, assorbendo fotoni molto specifici.
Possedendo diversi atomi, oltre alle interazioni intermolecolari e alle vibrazioni dei loro collegamenti (che assorbono anche l'energia), gli spettri di assorbimento delle molecole hanno la forma delle "montagne", che indicano le bande che includono le lunghezze d'onda in cui le transizioni elettroniche.
Grazie a questi spettri, un composto può essere caratterizzato, identificare e persino attraverso l'analisi multivariata, quantificalo.
Blu di metilene
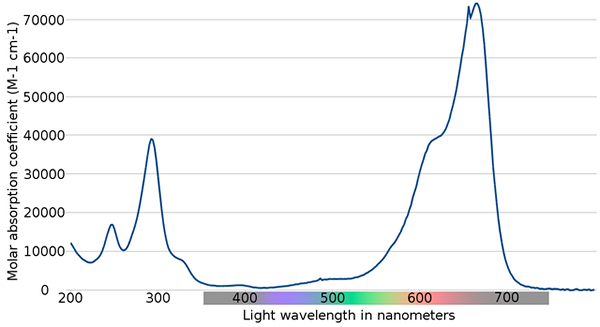 Spettro blu di metilene. Fonte: Wikimedia Commons
Spettro blu di metilene. Fonte: Wikimedia Commons Nell'immagine superiore viene mostrato lo spettro dell'indicatore di metilene blu. Come sottolinea il nome, è blu, ma può essere controllato con il suo spettro di assorbimento?
Può servirti: cambiamenti fisiciSi noti che ci sono bande tra le lunghezze d'onda di 200 e 300 nm. Tra 400 e 500 nm non c'è quasi assorbimento, cioè non assorbe i colori viola, blu o verde.
Tuttavia, presenta un'intensa banda di assorbimento dopo 600 nm e, quindi, ha transizioni elettroniche a bassa energia che assorbono i fotoni a luce rossa.
Di conseguenza, e dati gli alti valori delle assorbalità molari, il blu metilene presenta un colore blu intenso.
Clorofili A e B
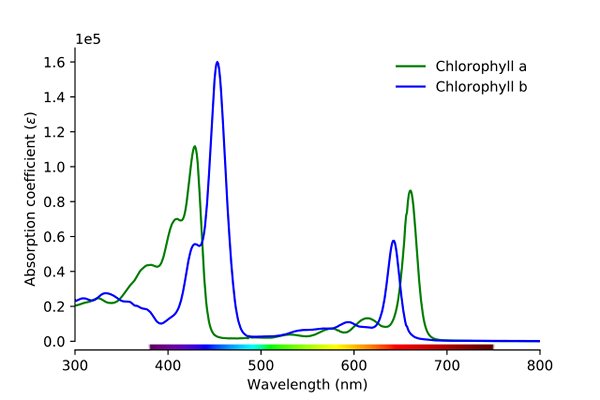 Spettro di assorbimento di clorofilla a e b. Fonte: Wikimedia Commons
Spettro di assorbimento di clorofilla a e b. Fonte: Wikimedia Commons Come si può vedere nell'immagine, la linea verde corrisponde alla clorofilla uno spettro di assorbimento, mentre la linea blu corrisponde a quella della clorofilla b.
Innanzitutto, le bande in cui le assorbalità molari sono più alte, in questo caso, quelle a sinistra, tra 400 e 500 nm. Clorofilla A colori viola intensamente, mentre la clorofilla B (linea blu) lo fa con il colore blu.
Assorbendo la clorofilla B intorno a 460 nm (blu), il colore giallo viene riflesso. D'altra parte, assorbe anche intensamente, circa 650 nm, luce arancione, il che significa che mostra il colore blu. Se il giallo e il blu sono miscelati, si traduce in colore verde.
E infine, la clorofilla A assorbi il colore viola bluastro e anche una luce rossa intorno a 660 nm. Pertanto, mostra un colore "morbido" verde di giallo.
Riferimenti
- Observatorio de Paris (s.F.). I diversi tipi di spettri. Recuperato in media 4.Osppm.fr
- Campus universitario di Ranals (s.F.). Spettrofometria: spettri di assorbimento e quantificazione colorimetrica delle biomolecole. Uco recuperato.È

