Equazioni di equilibrio termico, applicazioni, esercizi

- 3842
- 936
- Cosetta Messina
L'equilibrio termico di due corpi che si trovano in contatto termico è lo stato che si ottiene dopo un tempo abbastanza lungo in modo che le temperature di entrambi i corpi siano uguali a.
In termodinamica, il contatto termico di due corpi (o due sistemi termodinamici) è inteso come una situazione in cui i corpi hanno un contatto meccanico o sono separati ma a contatto con una superficie che consente solo il passaggio di calore da un corpo all'altro ).
-
 Figura 1. Dopo un po 'il ghiaccio e la bevanda raggiungeranno il loro equilibrio termico. Fonte: Pixabay
Figura 1. Dopo un po 'il ghiaccio e la bevanda raggiungeranno il loro equilibrio termico. Fonte: Pixabay
In contatto termico non dovrebbe esserci reazione chimica tra i sistemi in contatto. Ci dovrebbe essere solo scambio di calore.
Situazioni quotidiane in cui c'è uno scambio di calore viene presentata con sistemi come bevande fredde e vetro, caffè caldo e cucchiaino, o corpo e termometro, tra molti altri esempi.
[TOC]
Quando due o più sistemi sono in equilibrio termico?
La seconda legge della termodinamica stabilisce che il calore passa sempre dal corpo di temperatura più alta alla temperatura più bassa. Il trasferimento di calore cessa non appena le temperature sono equalizzate e viene raggiunto lo stato di equilibrio termico.
L'applicazione pratica dell'equilibrio termico è il termometro. Un termometro è un dispositivo che misura la propria temperatura, ma grazie all'equilibrio termico possiamo conoscere la temperatura di altri corpi, come quella di una persona o di un animale.
Il termometro a colonna di mercurio è posto a contatto termico con il corpo, ad esempio sotto la lingua, e ci si aspetta che abbastanza tempo raggiunga l'equilibrio termico tra il corpo e il termometro e che la sua lettura non varia di più.
Quando viene raggiunto questo punto, la temperatura del termometro è uguale al corpo.
La legge zero della termodinamica stabilisce che se un corpo A è in equilibrio termico con un corpo C e lo stesso corpo C è in equilibrio termico con B, allora A e B sono in equilibrio termico anche quando tra A e B non c'è contatto termico.
Concludiamo che due o più sistemi sono in equilibrio termico quando hanno la stessa temperatura.
Equazioni di equilibrio termico
Assumiamo un corpo a temperatura iniziale a contatto termico con un altro corpo B con temperatura iniziale TB. Supponiamo anche che ta> tb, quindi secondo la seconda legge il calore viene trasferito da a a b.
Dopo un po 'verrà raggiunto l'equilibrio termico e entrambi i corpi avranno la stessa temperatura finale TF. Questo avrà un valore intermedio per ta e tb, cioè ta> tf> tb.
La quantità di calore trasferita da A a B sarà qa = Ma ca (tf - ta), dove MA è la massa del corpo a, ca la capacità termica per unità di massa di A y (tf - ta) la differenza di temperatura. Se TF è inferiore al QA è negativo, indicando che il corpo dà calore.
Allo stesso modo per il corpo B devi Qb = MB CB (TF - TB); E se TF è maggiore di TB, allora QB è positivo, indicando che il corpo B riceve calore. Poiché il corpo A e B è in contatto termico tra di loro, ma isolati dall'ambiente, la quantità totale di calore scambiata dovrebbe essere nulla: QA + QB = 0
Quindi Ma Ca (tf - ta) + mb cb (tf - tb) = 0
Temperatura di equilibrio
Sviluppare questa espressione e cancellare la temperatura TF, si ottiene la temperatura di equilibrio termico finale.
-
 figura 2. Temperatura di bilanciamento finale. Fonte: sé realizzato
figura 2. Temperatura di bilanciamento finale. Fonte: sé realizzato
TF = (MA Ca TA + MB CB TB) / (MA Ca + MB CB).
Come caso particolare, considerare il caso che i corpi A e B siano identici in massa e nella capacità termica, in questo caso la temperatura di equilibrio sarà:
TF = (TA + TB) / 2 ↔ Se MA = MB e CA = CB.
Contatto termico con il cambio di fase
In alcune situazioni accade che quando due corpi vengono messi a contatto termico, lo scambio di calore provoca il cambiamento di stato o la fase in uno di essi. Se ciò accade, si deve prendere in considerazione che durante il cambiamento di fase non vi è alcun cambiamento di temperatura nel corpo che sta modificando il suo stato.
Se si verifica il cambio di fase di uno dei corpi nel contatto termico, viene applicato il concetto di calore latente L, che è l'energia per unità di massa necessaria per il cambio di stato:
Q = l ∙ m
Ad esempio, per sciogliere 1 kg di ghiaccio a 0 ° C, sono necessari 333,5 kJ/kg e quel valore è il calore latente della fusione del ghiaccio.
Durante la fusione, l'acqua solida viene cambiata in acqua liquida, ma quell'acqua mantiene la stessa temperatura del ghiaccio durante il processo di fusione.
Applicazioni
L'equilibrio termico fa parte della vita quotidiana. Ad esempio, esaminiamo questa situazione in dettaglio:
-Esercizio 1
Una persona desidera fare il bagno con acqua calda a 25 ° C. In un cubo posizionare 3 litri di acqua fredda a 15 ° C e in cucina calda acqua fino a 95 ° C.
Quanti litri di acqua calda devono aggiungere al cubo dell'acqua fredda per avere la temperatura finale desiderata?
Soluzione
Supponiamo che sia acqua fredda e acqua calda:
-
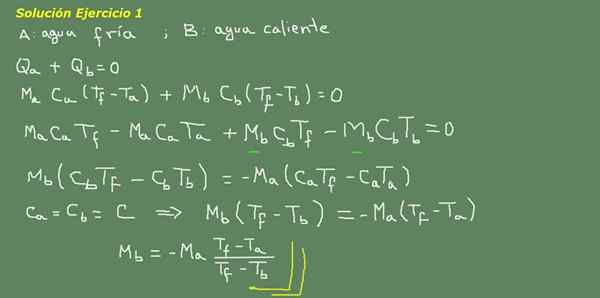 Figura 3. Soluzione dell'esercizio 3. Fonte: sé realizzato.
Figura 3. Soluzione dell'esercizio 3. Fonte: sé realizzato.
Proponiamo l'equazione di equilibrio termico, come indicato nel consiglio di amministrazione della Figura 3 e da lì cancelliamo l'acqua MB.
La massa iniziale di acqua fredda può essere ottenuta perché è nota la densità dell'acqua, che è 1 kg per ogni litro. Cioè, abbiamo 3 kg di acqua fredda.
Ma = 3kg
COSÌ
Mb = - 3 kg*(25 ° C - 15 ° C)/(25 ° C - 95 ° C) = 0,43 kg
Quindi è sufficiente con 0,43 LT di acqua calda per ottenere finalmente 3,43 litri di acqua calda a 25 ° C.
Esercizi risolti
-Esercizio 2
Viene introdotto un pezzo di metallo di 150 g di massa e con temperatura di 95 ° C a un contenitore contenente mezzo litro di acqua a una temperatura di 18 ° C. Dopo un po 'l'equilibrio termico e la temperatura dell'acqua e del metallo sono raggiunti è 25 ° C.
Supponiamo che il contenitore con acqua e metallo sia un thermos chiuso che non consente lo scambio di calore con l'ambiente.
Ottieni il calore specifico del metallo.
Soluzione
Per prima cosa calcoleremo il calore assorbito dall'acqua:
Qa = ma ca (tf - ta)
QA = 500G 1Cal/(G ° C) (25 ° C - 18 ° C) = 3500 calorie.
Questo è lo stesso calore dato dal metallo:
QM = 150 g cm (25 ° C - 95 ° C) = -3500 calorie.
Quindi possiamo ottenere la capacità termica del metallo:
Cm = 3500 cal/ (150 g 70 ° C) = ⅓ cal/ (g ° C).
Esercizio 3
Hai 250 C.C. di acqua a 30 ° C. A quell'acqua che si trova in un thermos isolante, vengono aggiunte 25 g di cubetti di ghiaccio a 0 ° C, con lo scopo di raffreddarlo.
Determinare la temperatura di equilibrio; Cioè, la temperatura che rimarrà una volta che tutto il ghiaccio si è sciolto e l'acqua ghiacciata si è riscaldata fino all'acqua che inizialmente aveva il vetro.
Soluzione 3
Questo esercizio può essere risolto in tre fasi:
- Il primo è la fusione del ghiaccio che assorbe il calore dall'acqua iniziale per sciogliersi e diventare acqua.
- Quindi viene calcolata la diminuzione della temperatura nell'acqua iniziale, perché ha dato calore (Qced<0) para fundir el hielo.
- Infine, l'acqua fusa (dal ghiaccio) deve essere bilanciata termicamente con l'acqua che esisteva inizialmente.
-
 Figura 4. Soluzione dell'esercizio 3. Fonte: sé realizzato.
Figura 4. Soluzione dell'esercizio 3. Fonte: sé realizzato.
Calcoliamo il calore necessario per la fusione del ghiaccio:
QF = L * MH = 333,5 kJ/kg * 0,025 kg = 8.338 kJ
Quindi, il calore assegnato dall'acqua per sciogliere il ghiaccio è qced = -qf
Questo calore assegnato dall'acqua scende la sua temperatura a un valore t che possiamo calcolare come segue:
T '= t0 - qf/(ma*ca) = 22.02 ° C
Dove CA è la capacità di calore dell'acqua: 4,18 kJ/(kg ° C).
Infine, la massa originale di acqua che è ora a 22,02 ° C produrrà calore all'acqua fusa dal ghiaccio che è a 0 ° C.
Infine, la temperatura di equilibrio verrà raggiunta dopo abbastanza tempo:
Te = (ma * t ' + mH * 0 ° C) / (Ma + mh) = (0,25 kg * 22,02 ° C + 0,025 kg * 0 ° C) / (0,25 kg + 0,025 kg).
Ottenere infine la temperatura di equilibrio:
TE = 20,02 ° C.
-Esercizio 4
Un pezzo di piombo da 0,5 kg lascia il forno a una temperatura di 150 ° C, che è abbastanza al di sotto del suo punto di fusione. Quel pezzo è posto in un contenitore con 3 litri di acqua a temperatura ambiente di 20 ° C. Determina la temperatura di equilibrio finale.
Calcola anche:
- Quantità di calore consegnato da piombo all'acqua.
- Quantità di calore assorbita dall'acqua.
Dati:
Calore di piombo specifico: CP = 0,03 calce/(G ° C); Calore dell'acqua specifico: Ca = 1 calce/(G ° C).
Soluzione
In primo luogo determiniamo la temperatura di equilibrio finale TE:
TE = (Ma Ca Ta + MP CP TP) / (MA Ca + MP CP)
TE = 20,65 ° C
Quindi la quantità di calore assegnata dal piombo è:
Qp = mp cp (te - tp) = -1.94 x 10³ lime.
La quantità di calore assorbita dall'acqua sarà:
Qa = ma ca (te - ta) = +1.94x 10³ lime.
Riferimenti
- Atkins, p. 1999. Chimica fisica. Omega Editions.
- Bauer, w. 2011. Fisica per ingegneria e scienze. Volume 1. Mc Graw Hill.
- Giancoli, d. 2006. Fisica: principi con applicazioni. 6 ° ... Ed Prentice Hall.
- Hewitt, Paul. 2012. Scienze fisiche concettuali. 5 °. Ed. Pearson.
- Resnick, r. (1999). Fisico. Vol. 1. 3a ed. in spagnolo. Azienda editoriale continentale S.A. di c.V.
- Rex, a. 2011. Fondamenti di fisica. Pearson.
- Sears, Zemansky. 2016. Fisica universitaria con fisica moderna. 14 °. Ed. Volume 1.
- Serway, r., Jewett, J. (2008). Fisica per la scienza e l'ingegneria. Volume 1. 7 °. Ed. Apprendimento del Cengage.
- « Caratteristiche del sistema di produzione continuo, vantaggi, esempi
- Ecuador Liberal Revolution Cause, Sviluppo e conseguenze »

