PI LINK
- 3034
- 871
- Kayla Serr
Spieghiamo qual è il collegamento PI, come si formano le sue caratteristiche e diamo diversi esempi
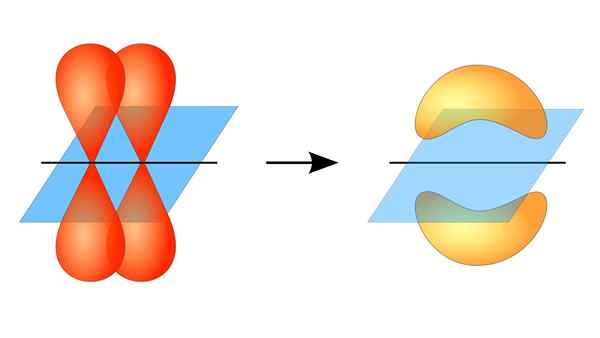
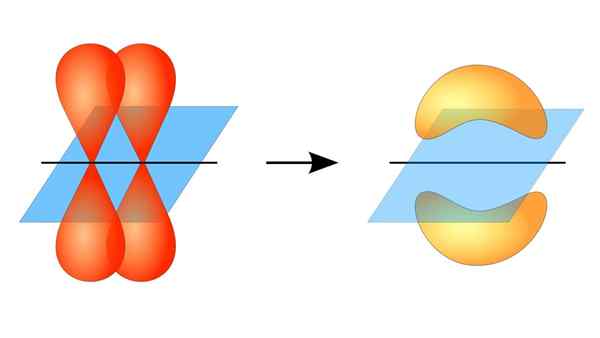 Due orbitali p formano un collegamento π
Due orbitali p formano un collegamento π Cos'è un collegamento PI?
UN PI LINK (π) è un tipo covalente di collegamento caratterizzato dalla prevenzione del movimento di rotazione libera degli atomi e originaria tra una coppia di orbitali atomici puri, tra le altre peculiarità. Ci sono collegamenti che possono essere formati tra gli atomi dai loro elettroni, che consentono loro di costruire strutture più grandi e complesse: molecole.
Questi collegamenti possono essere di varietà diverse, ma i più comuni in questo campo di studio sono il covalente. I legami covalenti, anche chiamati molecolari, sono un tipo di collegamento in cui gli atomi coinvolti condividono le coppie di elettroni.
Ciò può verificarsi a causa della necessità di atomi di cercare stabilità, formando così la maggior parte dei composti noti. In questo senso, i legami covalenti possono essere semplici, doppi o tripli, a seconda della configurazione dei loro orbitali e della quantità di coppie di elettroni condivise tra gli atomi coinvolti.
Questo è il motivo per cui ci sono due tipi di legame covalente che si formano tra atomi in base all'orientamento dei loro orbitali: i collegamenti Sigma (σ) e i collegamenti PI (π) (π).
È importante differenziare entrambi i collegamenti, poiché il collegamento Sigma è presentato in sindacati semplici e il PI in più sindacati tra atomi (due o più elettroni sono condivisi).
Com'è forma il collegamento PI?
Al fine di descrivere la formazione del collegamento PI, dovrebbe prima essere discusso sul processo di ibridazione, poiché interviene in alcuni importanti collegamenti.
L'ibridazione è un processo in cui si formano orbitali elettronici ibridi; Cioè, dove gli orbitali secondari atomici S e P possono essere miscelati. Ciò provoca la formazione di SP, Orbitali SP2 e sp3, che sono chiamati ibridi.
Può servirti: reazione reversibile: caratteristiche ed esempiIn questo senso, la formazione dei collegamenti PI si verifica grazie alla sovrapposizione di un paio di lobi appartenenti a un orbitale atomico su un'altra coppia di lobi che si trovano in un orbitale che fa parte di un altro atomo.
Questa sovrapposizione orbitale si verifica lateralmente, quindi la distribuzione elettronica è concentrata principalmente sopra e sotto il piano che formano i nuclei atomici collegati e fa sì che i legami PI siano più deboli dei legami Sigma.
Quando si parla della simmetria orbitale di questo tipo di unione, va detto che è uguale a quello del tipo P orbitale puPLO che viene osservata attraverso l'asse formato dal collegamento. Inoltre, questi sindacati sono principalmente costituiti da orbitali p.
Formazione di legame PI in diverse specie chimiche
Poiché i legami PI sono sempre accompagnati da uno o due collegamenti in più (un sigma o un altro pi e un sigma), è rilevante sapere che il doppio legame si è formato tra due atomi di carbonio (costituito da un legame Sigma e un PI) possiede un'energia di collegamento inferiore a quella corrispondente al doppio del collegamento Sigma tra i due.
Ciò è spiegato dalla stabilità del collegamento Sigma, che è maggiore di quella del legame PI perché la sovrapposizione degli orbitali atomici in quest'ultimo si verifica in parallelo nelle regioni sopra e sotto i lobi, accumulando la distribuzione elettronica in modo più lontano di atomico nuclei.
Nonostante ciò, quando i collegamenti PI e Sigma sono combinati un collegamento multiplo più forte del semplice collegamento da solo, che può essere verificato osservando le lunghezze dei collegamenti tra vari atomi con collegamenti semplici e multipli.
Può servirti: ossidi non metalliciEsistono alcune specie chimiche che sono studiate dal loro comportamento eccezionale, come i composti di coordinazione con elementi metallici, in cui gli atomi centrali sono uniti solo da legami PI.
Caratteristiche del collegamento PI
Non consente il movimento di rotazione libera degli atomi
Le caratteristiche che distinguono i collegamenti PI da altri tipi di interazioni tra le specie atomiche sono descritte di seguito, a partire dal fatto che questa unione non consente il movimento di rotazione libera degli atomi, come il carbonio. Per questo motivo, se c'è una rotazione degli atomi, si verifica la rottura del legame.
Sovrapposizione tra orbitali da parte di due regioni parallele
Allo stesso modo, in questi collegamenti la sovrapposizione tra gli orbitali avviene attraverso due regioni parallele, rendendole una diffusione maggiore rispetto ai legami Sigma e che, per questo motivo, sono più deboli.
Tra un paio di puri orbitali atomici
D'altra parte, come menzionato sopra, il collegamento PI viene sempre generato tra una coppia di orbitali atomici puri; Ciò significa che viene generato tra orbitali che non hanno subito processi di ibridazione, in cui la densità degli elettroni è per lo più concentrata sopra e sotto il piano formato dall'unione covalente.
In questo senso, più di un collegamento PI può essere presentato tra un paio di atomi, sempre accompagnati da un collegamento Sigma (in doppio legame).

Allo stesso modo, puoi dare un triplo legame tra due atomi adiacenti, che è formata da due legami PI in posizioni che formano piani perpendicolari tra loro e un legame sigma tra i due atomi.
Può servirti: acido umico: struttura, proprietà, ottenimento, usiEsempi di collegamenti PI
Molecola di etilene
Come precedentemente affermato, le molecole costituite dagli atomi uniti da uno o più legami PI hanno sempre più collegamenti; cioè doppio o triplo.
Un esempio di questo è la molecola di etilene (h2C = ch2), che è costituito da una doppia unione; Cioè, un legame PI e un sigma tra i suoi atomi di carbonio, oltre ai legami Sigma tra carboni e idrogeni.
Molecola di acetilene
Da parte sua, la molecola di acetilene (H-CESS) ha un triplo legame tra i suoi atomi di carbonio; Cioè, due legami PI che formano piani perpendicolari e un legame sigma, oltre ai corrispondenti legami di carbonio-idrogeno.
Benzene e derivati
Vengono anche presentati legami PI tra molecole cicliche, come il benzene (C6H6) e i suoi derivati, la cui disposizione si traduce in un effetto chiamato risonanza, che consente alla densità elettronica di migrare tra atomi e concessione, tra le altre cose, una maggiore stabilità al composto.
Dicaron
Per esemplificare le eccezioni precedentemente menzionate, i casi della molecola dicarbonale (C = C, in cui entrambi gli atomi hanno una coppia di elettroni accoppiati) e il composto di coordinamento chiamato HexacarbondildiHierro (rappresentato come Faith2(CO)6, che è formato solo da collegamenti PI tra i suoi atomi).

