Triplo legame covalente
- 4465
- 1024
- Enzo De Angelis
Spieghiamo cos'è un triplo collegamento, le sue caratteristiche e diamo diversi esempi
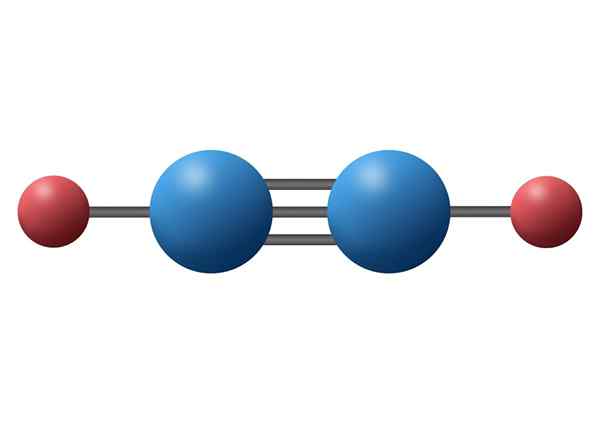 Molecola di acetilene (C2H2) con il suo triplo legame tra i due atomi di carbonio
Molecola di acetilene (C2H2) con il suo triplo legame tra i due atomi di carbonio Cos'è un triplo collegamento covalente?
IL Tripli legami covalenti Sono collegamenti chimici in cui due atomi condividono tre coppie di elettroni. In altre parole, sono legami covalenti formati da un totale di sei elettroni di valenza che ruotano intorno a due atomi.
Ci sono molti composti chimici che contengono tripli collegamenti. Ad esempio, i composti organici come gli alchini contengono legami covalenti tripli C-C. I nitrili sono anche caratterizzati da un gruppo che contiene un carbonio collegato all'azoto per mezzo di un legame covalente triplo C-N. Altri composti inorganici come l'azoto molecolare nell'aria, contengono anche tripli legami covalenti.
Avere 6 elettroni che girano intorno a due nuclei dà tripli collegamenti molte caratteristiche particolari. Sia la forma delle molecole che le contengono e le reazioni chimiche a cui possono partecipare sono diverse da quelle di legami doppi o semplici.
Caratteristiche del collegamento triplo covalente
Sono formati da 6 elettroni
Questi legami sono formati da 6 elettroni e sono formati quando ciascuno dei due atomi ha coinvolto le condivisioni tre dei suoi elettroni scomparsi con l'altro. Questo è il motivo per cui sono chiamati tripli collegamenti, poiché hanno triplo il numero di elettroni del semplice legame covalente.
Hanno un collegamento Sigma Link (σ) e due PI (π)
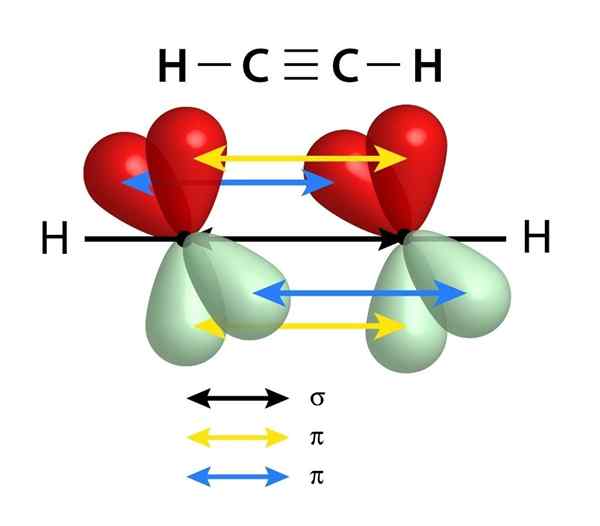 Schema dei collegamenti che costituiscono un triplo legame tra due atomi di carbonio. La freccia nera del centro rappresenta il collegamento Sigma, mentre il giallo e il blu rappresentano ciascuno dei due legami PI
Schema dei collegamenti che costituiscono un triplo legame tra due atomi di carbonio. La freccia nera del centro rappresenta il collegamento Sigma, mentre il giallo e il blu rappresentano ciascuno dei due legami PI Simile ai doppi legami, i tripli collegamenti sono anche formati da un collegamento Sigma che passa attraverso il centro della linea che si unisce ai due atomi collegati. Tuttavia, a differenza dei doppi collegamenti che ne hanno uno, i tripli collegamenti hanno due collegamenti PI oltre al collegamento Sigma.
Può servirti: cloruro di rame (i) (cucl): struttura, proprietà, usiQuasi sempre formano composti lineari
Quando due atomi di carbonio formano un triplo collegamento, ognuno ha ancora la possibilità di formare un collegamento semplice aggiuntivo con un altro atomo (poiché il carbonio può formare 4 legami in totale).
In questi casi, sia i due carboni che gli altri due atomi attaccati ad essi formaranno una linea retta. Questa forma che la molecola acquisisce è chiamata geometria lineare.
Sono i legami covalenti più forti
Quando si confrontano i tripli collegamenti tra due atomi con i legami doppi e semplici tra quegli stessi atomi, si osserva che i tripli collegamenti sono sempre più forti degli altri tipi di legame covalente. Ciò significa che è più difficile rompere un triplo link di un doppio o semplice.
Questo perché, inoltre, dover rompere il collegamento Sigma (che è presente anche in legami semplici e doppi), non si deve rompere (come in doppi collegamenti) ma due legami PI aggiuntivi.
Sono più corti dei doppi legami o così semplici
A causa dello stesso fatto di essere collegamenti più forti, i tripli collegamenti gestiscono.
Rappresentano due insaturazioni
Ogni carbonio che ha un triplo legame avrà solo un collegamento aggiuntivo con un altro atomo. Ciò significa che tale carbonio sarebbe collegato solo a due atomi, anziché a quattro, quindi ha meno idrogeno di quanto potrebbe possedere se formasse solo legami semplici.
Può servirti: heptano (c7h16): struttura, proprietà e usiQuesto si chiama insaturazione e i composti con tripli collegamenti hanno due insaturazione, poiché ciascuno dei due carboni si adatterebbe a 2 idrogeni aggiuntivi, se non per il triplo collegamento.
Sono collegamenti rigidi
Come i doppi legami, i tripli collegamenti sono rigidi e difficili da piegare o torcere. Ciò è dovuto sia alla forza di collegamento maggiore che alla lunghezza più bassa.
Possono agire come basi
Alcuni composti con tripli collegamenti possono utilizzare gli elettroni PI di detto collegamento a collegamento o accettare ioni H+, Pertanto, fungendo da basi.
Possono idrogeno per dare collegamenti doppi o semplici
L'insaturazione del triplo collegamento può essere rimossa rompendo i legami PI e aggiungendo idrogeni ai due carboni. Questo si chiama idrogenazione. Se viene aggiunta solo una molecola di idrogeno a un triplo legame, diventerà un doppio legame. Se vengono aggiunte due molecole di idrogeno, diventerà un legame semplice.
Esempi di collegamenti tripli covalenti
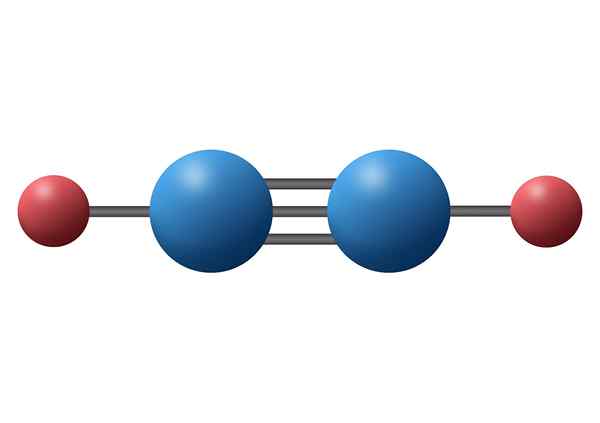
Molecola di azoto (n2)
La molecola di azoto contiene un triplo legame covalente tra i due atomi di azoto. Ogni atomo condivide i suoi tre elettroni di valenza scomparve con l'altro e ogni nuovo paio di elettroni diventa il legame Sigma o uno dei due legami PI che la molecola possiede.
 Molecola di azoto
Molecola di azoto In questo caso, sia i due atomi di azoto che le coppie di elettroni incolume che ognuno di essi si trova lungo una linea retta.
Il corretto (un'alkyne di formula C3H4)
Il giusto è la seconda alkyne più semplice che esiste. Questo composto è costituito da una catena a tre carbonio, due delle quali sono collegate attraverso un triplo collegamento covalente.
Può servirti: idrocarburi insaturi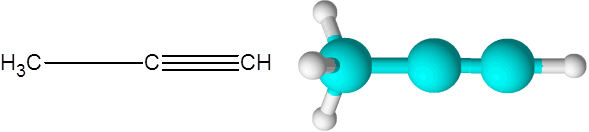 Propino molecola
Propino molecola Qui puoi anche vedere che i tre carboni e l'ultimo atomo di idrogeno (quello a destra) forma una linea retta. Nel modello si può anche vedere che il semplice collegamento C-C è più lungo del collegamento Triple C-C.
Monossido di carbonio (CO)
Il monossido di carbonio è un gas inorganico tossico che ha un atomo di carbonio negativo e ossigeno positivo collegato per mezzo di un triplo legame covalente. In questo caso, è un legame polare, a causa della differenza di elettronegatività tra carbonio e ossigeno.
 Molecola di monossido di carbonio
Molecola di monossido di carbonio

